Сильные электролиты.
Ионная сила и активность

Общая интенсивность межионных взаимодействий в растворе характеризуется ионной силой раствора (/), равной полусумме произведений концентрации каждого иона (с,)2 в растворе на квадрат его заряда (z,): Ля предложенной ими в 1923 г., каждый ион под действием своего электрического поля притягивает к себе некоторое количество ионов противоположного знака, образуя так называемую ионную атмосферу… Читать ещё >
Сильные электролиты. Ионная сила и активность (реферат, курсовая, диплом, контрольная)
Понятие констант диссоциации применимо только для слабых электролитов, для которых процесс диссоциации обратим.
Экспериментально определяемые значения коллигативиых свойств растворов (понижение температуры замерзания или повышение температуры кипения раствора) сильных электролитов оказываются ниже ожидаемых в предположении их полной диссоциации, причем эти расхождения увеличиваются при увеличении концентрации растворенного вещества.
Изучение электрической проводимости таких растворов также дает заниженные значения, что привело к введению понятия кажущейся степени диссоциации сильного электролита.
Эти явления связаны с тем, что в растворах, имеющих высокую концентрацию ионов, межионные взаимодействия достаточно сильны для того, чтобы существенно понизить их подвижность и химическую активность.
Согласно статистической теории сильных электролитов Дебая1 — Хюкке-
ля предложенной ими в 1923 г., каждый ион под действием своего электрического поля притягивает к себе некоторое количество ионов противоположного знака, образуя так называемую ионную атмосферу.
Для количественных расчетов, касающихся растворов сильных электролитов, вместо молярных концентраций ионов используются активные концентрации, или активности (а), учитывающие вышеупомянутые межионные взаимодействия. Активная концентрация связана с молярной концентрацией иона через коэффициент активности (/):

Величина коэффициента активности практически не зависит от природы иона и определяется только его собственным зарядом, а также зарядами и концентрациями всех остальных ионов в растворе.
Общая интенсивность межионных взаимодействий в растворе характеризуется ионной силой раствора (/), равной полусумме произведений концентрации каждого иона (с,)2 в растворе на квадрат его заряда (z,):
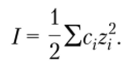
Значения коэффициентов активности при различной ионной силе растворов приведены в табл. 6.2. Для определения активной концентрации нужно подставить найденный с помощью таблицы коэффициент активности в уравнение (6.3).
Таблица 6.2
Коэффициенты активности ионов при различных ионных силах растворов
Ионы. | Ионная сила раствора. | ||||||||||
0,001. | 0,002. | 0,005. | 0,01. | 0,02. | 0,05. | 0,1. | 0,2. | 0,3. | 0,5. | 1,0. | |
H3o+ | 0,98. | 0,97. | 0,95. | 0,92. | 0,91. | 0,88. | 0,86. | 0,83. | 0,80. | 0,79. | 0,85. |
Li+ | 0,98. | 0,96. | 0,95. | 0,93. | 0,91. | 0,87. | 0,87. | 0,80. | |||
Rb+, Cs+, Ag+, NH4+ | 0,98. | 0,96. | 0,95. | 0,92. | 0,90. | 0,85. | 0,80. | 0,75. | 0,70. | 0,63. | 0,52. |
K+, СГ, Br", r, no2, no3 | 0,98. | 0,96. | 0,95. | 0,93. | 0,90. | 0,85. | 0,80. | 0,76. | 0,71. | 0,64. | 0,53. |
OH, F, CNS" Mn04, C104 | 0,96. | 0,95. | 0,93. | 0,90. | 0,87. | 0,82. | 0,76. | 0,68. | 0,63. | 0,56. | 0,46. |
Na Н2Р04 | 0,98. | 0,96. | 0,95. | 0,90. | 0,87. | 0,82. | 0,77. | 0,73. | 0,70. | 0,67. | 0,63. |
SOf-, Cr04- | 0,90. | 0,87. | 0,80. | 0,74. | 0,66. | 0,55. | 0,45. | 0,36. | |||
TiT^TcofTsofTHPof^of. | 0,87. | 0,86. | 0,82. | 0,66. | 0,62. | 0,52. | 0,36. | 0,29. | 0,25. | 0,22. | 0,18. |
Sr2+, Ba2+. Cd2+, Hg2+, S2^. | 0,90. | 0,87. | 0,81. | 0,74. | 0,67. | 0,56. | 0,47. | 0,38. | 0,34. | 0,31. | 0,27. |
Ca2+, Cu2+, Zn2+, Fe2+, Mn2+, Ni2+, Co2+ | 0,91. | 0,87. | 0,81. | 0,75. | 0,68. | 0,75. | 0,49. | 0,41. | 0,36. | 0,33. | 0,29. |
Mg2+, Be2+ | 0,91. | 0,87. | 0,81. | 0,76. | 0,69. | 0,60. | 0,52. | 0,45. | 0,41. | 0,35. | 0,30. |
Pof, [ Fe (CN)fi|:i | 0,80. | 0,73. | 0,61. | 0,51. | 0,40. | 0,25. | 0,16. | 0,10. | |||
Al3+, Fe3+, Cr3+ | 0,80. | 0,74. | 0,63. | 0,54. | 0,45. | 0,33. | 0,25. | 0,18. | |||
- 1 Петер Йозеф Вильгельм Дебай (1884—1966) — голландский физик и физико-химик, лауреат Нобелевской премии, но химии (1936).
- 2 Для более точных расчетов вместо концентраций необходимо использовать значения моляльности.
Чем выше значение ионной силы раствора и чем больше заряд иона, тем меньше коэффициент активности, а следовательно, и активность данного иона в растворе.