Основные классы неорганических соединений

1] Конкретные определения понятий основания и кислоты могут видоизменяться в зависимости от структурных особенностей соединений. Некоторые из этих определений оказываются более ограниченными по сравнению с другими и вследствие этого обладают меньшейобластью применимости. В различных случаях возникает необходимость использования тоодних, то других представлений об основаниях и кислотах. В этой… Читать ещё >
Основные классы неорганических соединений (реферат, курсовая, диплом, контрольная)
Химические соединения, несмотря на их многообразие, делятся на простые и сложные. К простым относятся металлы и неметаллы. Сложные вещества в неорганической химии делятся на четыре класса: оксиды, основания, кислоты и соли.
Классификация веществ облегчает их изучение, так как позволяет сопоставлять их между собой и выявлять важные взаимосвязи между ними.
Оксиды. Это бинарные соединения, молекулы которых состоят из атомов двух элементов, один из которых кислород в степени окисления -2.
Оксиды получают взаимодействием простых веществ с кислородом; окислением сложных веществ; разложением нитратов, карбонатов, сульфатов; дегидратацией некоторых гидроксидов при нагревании, а также разложением высших оксидов или, наоборот, доокислением низших оксидов до высших.
По адаптированному варианту номенклатуры ИЮПАК, для оксидов следует придерживаться следующих правил.
- 1. Электроположительную составляющую в формулах следует помещать на первое место, а в названиях — на второе место.
- 2. Стехиометрические отношения можно указывать греческими умножающими префиксами (моно, ди, три, тетра, пента, гекса, гейта, окта и т. д.).
Указанные правила особенно применимы для оксидов, образованных неметаллами. Например: N20 — оксид диазота; N02 — диоксид азота; N204 — тетраоксид диазота; Мп02 — диоксид марганца.
- 3. Стехиометрические отношения можно выражать в соответствии со степенью окисления электроположительной составляющей, которая обозначается римской цифрой в круглых скобках сразу же после названия элемента: Мп02 — оксид марганца (1У); FeO — оксид железа (Н); Fe203 — оксид железами); Р205 — оксид фосфора (У); As203 — оксид мышьяка (Ш).
- 4. Ангидридам неорганических кислот следует давать названия как оксидам, в соответствии с пунктами 1—3. Например, К;05 — диазот пентаоксид, или азотный ангидрид, или ангидрид азотной кислоты.
Различают солеобразующие и несолеобразующие (безразличные) оксиды. К последним относятся такие, которые не образуют ни кислот, ни оснований (например, NvO, NO, SiO).
Солеобразующие оксиды подразделяются на основные (с ударением на второй слог), кислотные и амфотерные.
Основными называются оксиды, которым в качестве гидратных соединений соответствуют основания. Основные оксиды реагируют с кислотами с образованием соли и воды и не реагируют со щелочами. Как правило, это оксиды металлов в степени окисления +1 и +2. Оксиды щелочных и щелочноземельных металлов способны растворяться в воде с образованием оснований. Следовательно, основным оксидам в качестве гидратных соединений соответствуют основания. Например, оксиды К20 и СаО хорошо растворимы в воде с образованием соответствующих оснований:
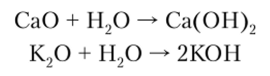
Все остальные основные оксиды с водой не взаимодействуют. Например FeO, Ag20 настолько нерастворимы в воде, что они не участвуют в реакциях образования основания, однако они нейтрализуют кислоты и не взаимодействуют со щелочами, поэтому считаются основными:
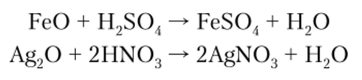
Характерным химическим свойством основных оксидов является их взаимодействие с кислотами с образованием соли и воды.
Кислотными называются оксиды, которые, растворяясь в воде, образуют кислоты или для которых можно представить гипотетическую реакцию образования кислоты. Поэтому кислотным оксидам в качестве гидратных соединений соответствуют кислоты. Оксиды S02, S03, P2Os и им подобные хорошо растворимы в воде с образованием кислот:
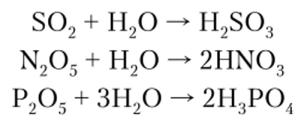
Оксид Si02 практически нерастворим в воде, однако он нейтрализует основания, следовательно, является кислотным оксидом:
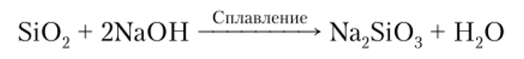
Характерным химическим свойством кислотных оксидов является их взаимодействие с основаниями с образованием соли и воды.
Амфотерными называются такие оксиды, которые в зависимости от условий проявляют основные и кислотные свойства, т. е. ведут себя как основные оксиды при взаимодействии с кислотами и как кислотные оксиды при взаимодействии со щелочами.
Не все амфотерные оксиды в одинаковой степени взаимодействуют с основаниями и кислотами. У одних более выражены основные свойства, у других — кислотные.
Свойства амфотерных оксидов показаны на примере ZnO:
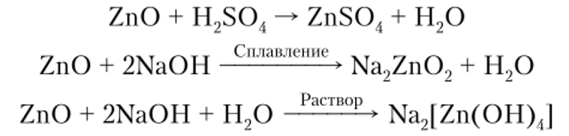
Основания[1]. Это сложные вещества, в молекуле которых атом металла связан с одной или несколькими гидроксогруппами (—ОН), числом которых определяется кислотность основания. Например, NaOH — однокислотное основание, Са (ОН)2 — двукислотиое основание и т. д.
При написании названий оснований придерживаются тех же правил, что и в случае оксидов: на первом месте слово «гидроксид», а затем добавляется название электроположительной составляющей: NaOH — гидроксид натрия; Са (ОН)2 — гидроксид кальция.
Если один и тот же элемент образует соединения переменного состава, то в каждом случае после его названия в круглых скобках указывают степень либо с помощью греческих числительных показывают число ОН-групп:
- • Fe (OH)2 — гидроксид железа (П), или дигидроксид железа;
- • Fe (OII)3 — гидроксид железа (Ш), или григидроксид железа.
Растворимые в воде основания называются щелочами (например, КОН,.
NaOH, Са (ОН)2).
Основания характеризуются высокой реакционной способностью. Важнейшее химическое свойство оснований — взаимодействие их с кислотами (реакция нейтрализации) с образованием соли и воды:
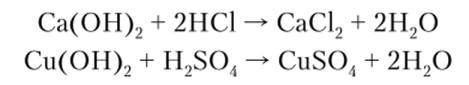
Характерная особенность оснований — их способность изменять окраску индикаторов, что широко используется в аналитической химии для распознавания оснований. Так, бесцветный раствор фенолфталеина в присутствии следов щелочи приобретает малиновую окраску, метиловый оранжевый становится желтым, а красный лакмус приобретает синюю окраску.
Кислоты. Это сложные вещества, в состав молекул которых входят атомы водорода, способные замещаться атомами металла. Числом атомов водорода определяется основность кислот: НС1 — одноосновная кислота, H2S04 — двухосновная и т. д.
В зависимости от элементного состава различают два типа кислот: кислородсодержащие (оксокислоты) и бескислородные. Названия кислот производят от того элемента (характеристического атома), от которого она образована. В бескислородных кислотах кислотный остаток приобретает окончание -ид, и вся молекула рассматривается как двойное соединение водорода, где электроположительной составляющей является водород. Например, НС1 — хлороводородная кислота, H2S — сероводородная кислота, HCN — циановодородная кислота.
В состав кислородсодержащих кислот входят многоатомные анионы (электроотрицательные составляющие). При этом названия анионов приобретают окончания -am, если кислотообразующий атом находится в высшей степени окисления, или —ит, если кислотообразующий атом находится в промежуточной степени окисления: S04~ — сульфат, СЮ3 — хлорат, SO3 — сульфит и т. д. Названия же кислот образуются из прилагательных с окончаниями -пая, -овая, -ватая и -истая, -овистая, -ватистая в зависимости от окончаний анионов -am и -ит соответственно. Следовательно, НМ02 — азотистая кислота (нитрит); H2S03 — сернистая кислота (сульфит), H2S04 — серная кислота (сульфат), Н2Сг04 — хромовая кислота (хромат), НСЮ3 — хлорноватая кислота (хлорат), НСЮ — хлорноватистая кислота (гипохлорит).
Кислоты с одним и тем же характеристическим атомом различаются с помощью префиксов: гипо- применяют для обозначения более низкой степени окисления, например: НСЮ — гипохлористая кислота (гипохлорит); НВгО — гипобромистая кислота (гипобромит); НЮ — гиноиодистая кислота (гипоиодит). Для этих кислот в отечественной химической терминологии укоренились названия хлорноватистая, бромноватистая, иодноватистая кислоты.
Префикс пер- применяется для обозначения максимальной степени окисления характеристического атома в кислотах, образованных элементами 17-й и 7-й групп. Например, НСЮ4 — перхлорная кислота (перхлорат) для 17-й группы, НМп04 — пермарганцевая кислота (перманганат) для 7-й группы. В отечественной химической терминологии префикс пер- используется только в названии солей, в названиях же кислот этот префикс принято опускать.
Префикс пер- не следует путать с пероксо-, который применяется для обозначения пероксокислот и указывает на замещение О2- ионом [02]2- (например, H2S2Os — пероксодисерная кислота).
Префиксы орто- и мета- применяются для обозначения кислот с одним и тем же характеристическим элементом, но отличающихся друг от друга числом гидроксогруии, т. е. по «содержанию воды»:
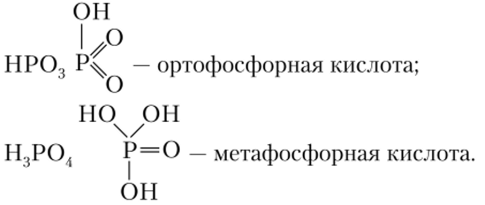
Ниже приведены названия некоторых оксокислот:
Н3В03 — ортоборная кислота;
Н2СОз — угольная кислота;
H4Si04 — ортокремниевая кислота;
H2Si03 — метакремниевая кислота;
H3As04 — мышьяковая кислота;
H3As03 — мышьяковистая кислота;
H2S04 — серная кислота;
H2S05 — пероксомоносерная кислота;
H2S207 — дисерная кислота;
Н3Р04 — ортофосфорная кислота;
(НРОэ)и — метафосфорная кислота;
НСЮ4 — хлорная кислота;
НСЮ3 — хлорноватая кислота;
НСЮ2 — хлористая кислота;
НС10 — хлорноватистая кислота.
Важнейшее химическое свойство кислот — их способность взаимодействовать с основаниями с образованием соли и воды:
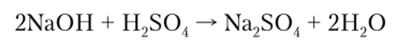
Большинство кислот в водных растворах взаимодействуют с металлами в соответствии с их положением в электрохимическом ряду металлов (см. гл. 9):
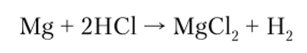
Соли. Это сложные вещества, которые можно рассматривать как продукты полного или частичного замещения атомов водорода в молекуле кислоты на металл (или же продукты полного или частичного замещения гидроксильных групп в молекуле основания на кислотный остаток).
По составу соли подразделяют на средние (нормальные), кислые и основные.
Средние, или нормальные, соли Са3(Р04)2, MgS04, K7S04 следует рассматривать как продукты полного замещения атомов водорода в молекуле кислоты.
Кислые соли Ca (H2P04)2, CaHP04, NaHS04 — это продукты частичного, неполного замещения атомов водорода в молекуле кислоты на атом металла.
Основные соли Al (OH)S04, Mg (OII)I можно рассматривать как результат частичного замещения гидроксогрупп в молекуле основания на кислотный остаток.
Если в образовании соли участвуют один металл и две кислоты, то они называются смешанными (двойными по аниону), а если два металла и одна кислота — двойными, но катиону.
В формулах и названиях солей электроположительная составляющая (катион) всегда помещается на первом месте. Одноатомные катионы следует называть по названию элемента без его изменения или добавления суффикса: Си+ — ион меди (1); Си2+ — ион меди (П); К+ — ион калия.
Названия для одноатомных анионов состоят из названия элемента с окончанием -ид: Н — гидрид-ион; О2- — оксид-ион; F- — фторид-ион; S2- — сульфид-ион; Вг" — бромид-ион; С1~ — хлорид-ион.
Окончание -ит употребляется для обозначения низшего состояния окисления: СЮ2 — хлорит-ион; N02 — нитрит-ион; СЮ — гипохлоригион; N7022" — гипонитрит-ион; ВЮ — гипобромит-ион; As03" — арсенитион; 10 — гипоиодит-ион; S03~ — сульфит-ион; S202" — тиосульфит-ион; S201~ — дисульфит-ион; SeO2- — селенит-ион; — дитионит-ион.
При написании формул солей на первом месте указывается катион: NaCl — хлорид натрия; CaS04 — сульфат кальция.
Если электроположительная составляющая образует катион с различной степенью окисления, то при написании таких солей степень окисления элемента указывается римской цифрой, которая ставится в круглых скобках сразу же после названия элемента: FeCl2 — хлорид железа (П); FeCl3 — хлорид железа (Ш); CuS04 — сульфат меди (Н).
Названия кислых солей образуют в соответствии с приведенным общим правилом, но с добавлением слова префикса гидро-. При необходимости перед водородом указывается числовой префикс: NaHC03 — гидрокарбонат натрия; Са (Н2Р04)2 — дигидрофосфат кальция; MgHP04 — гидрофосфат магния; KHS — гидросульфид калия.
Для двойных солей по аниону в формулах все катионы предшествуют анионам. Катионы должны перечисляться в соответствии с русским алфавитом: KMgF3 — фторид калия магния; KNaC03 — карбонит калия натрия; MgNH4P04 — фосфат аммония магния; NaNH4HP04 — гидрофосфат аммония натрия.
Анионы должны перечисляться в алфавитном порядке, невзирая на их порядок в формулах: NaCl • NaF • 2Na7S04 — гексанатрий бис (сульфат) хлорид фторид.
Умножающие числовые префиксы бис-, триси т.д. применяются с указанными анионами, поскольку префиксы ди-, трии т.д. уже заняты для обозначения.
Основные соли и оксосоли (оксидные) следует рассматривать как двойные соли, содержащие анионы ОН и О2-, и тогда к ним применимы правила, описанные выше: MgOHCl — хлорид гидроксомагния; (СиОН)9С03 — карбонат гидроксомеди (П); A1(0H)2N03 — нитрат дигидроксоалюминия; BiON03 — нитрат оксовисмута (Ш); SbOCl — хлорид оксосурьмы (Ш).
Фармакопейное название лекарственных веществ, в отличие от адаптированного варианта номенклатуры ИЮПАК, на первое место ставит электроположительную часть соединения: MgO — магния оксид; Н202 — водорода перексид; NaCl — натрия хлорид; КВг — калия бромид; NaHC03 — натрия гидрокарбонат.
Соли представляют собой твердые кристаллические вещества. Растворимость солей в воде зависит от их состава. Так, подавляющее большинство солей, образованных щелочными металлами, легко растворимы в воде (NaCl, KN03, Na2SO^). Другие соли, наоборот, трудно растворимы в воде или практически нерастворимы: MgCOs, РЬС12, BaS04 и т. д.
Соли являются реакционноспособными соединениями.
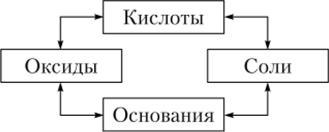
Сопоставляя свойства важнейших классов неорганических соединений, легко заметить генетическую связь между ними, что можно выразить следующей схемой:
- [1] Конкретные определения понятий основания и кислоты могут видоизменяться в зависимости от структурных особенностей соединений. Некоторые из этих определений оказываются более ограниченными по сравнению с другими и вследствие этого обладают меньшейобластью применимости. В различных случаях возникает необходимость использования тоодних, то других представлений об основаниях и кислотах. В этой связи в разделе, посвященном электролитической диссоциации, определения понятий «основание» и «кислота» будутданы с позиций, которые в настоящее время считаются общепринятыми.