Процесс растворения газов в жидкостях может осуществляться двояко: либо за счет вандерваальсовых сил взаимодействия между молекулами газа и растворителя, либо за счет химического взаимодействия между ними. Так, азот, кислород, водород, метан растворяются в воде за счет физических дисперсионных сил, а аммиак — за счет взаимодействия с водой: 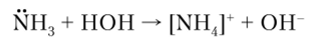
Если газообразная молекула является полярной и возможна диссоциация на ионы (например, НС1), то растворение сопровождается распадом на ионы с одновременной их гидратацией. По мере насыщения молекулы газа способны постепенно выделяться из раствора. Если скорость выделения газа из жидкости равна скорости растворения, то при постоянном давлении и температуре устанавливается динамическое равновесие и жидкость насыщается газом. Растворение газа в жидкости подчиняется закону Генри: масса газа, растворяющегося в данном объеме жидкости при постоянной температуре, прямо пропорциональна парциальному давлению газа:
где С — концентрация газа в насыщенном растворе;/; — парциальное давление газа; к — коэффициент пропорциональности.
Из закона Генри следует, что:
- 1) объем растворенного газа не зависит от давления;
- 2) если над жидкостью находится смесь газов, то каждый из них растворяется пропорционально своему парциальному давлению.
Оба следствия из закона Генри справедливы лишь для разбавленных растворов, а также если газ или смесь газов находятся при сравнительно низком давлении и подчиняются законам идеальных газов.
Итак, при низких значениях давления и температуры газ и жидкость представляют собой равновесную систему. Это равновесие наступает тогда, когда в данный отрезок времени из раствора выходит столько же молекул газа, сколько их из газообразной фазы входит в раствор. Если молекулы газа, находясь в растворе, не претерпевают никакого изменения (не диссоциируют, не уплотняются и т. д.), то такая равновесная система подчиняется закону действующих масс.
С повышением температуры равновесие системы «газ — жидкость» нарушается, поскольку при этом увеличивается поступательное движение молекул газа и они улетучиваются из раствора, т. е. в данный отрезок времени количество выделяющихся из раствора молекул газа больше, чем-то, которое из газообразной фазы переходит в раствор.
Растворимость газов в воде уменьшается в присутствии полярных или ионных веществ. Это объясняется тем, что в растворе происходит сольватация полярных или ионных молекул, вследствие чего часть молекул растворителя связывается. На растворение газа остается меньшее количество несвязанного растворителя, поэтому растворимость газа снижается. Ионные (или полярные) вещества гораздо прочнее связываются с молекулами растворителя, чем газы.