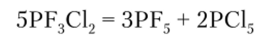Фосфор.
Общая и неорганическая химия

Кислородные соединения фосфора более устойчивые, чем азота, а водородные соединения менее прочные по сравнению с аммиаком. Если NH3 можно получить непосредственным синтезом из азота и водорода, то РН3 получают косвенно. Химическая активность фосфора значительно выше, чем азота. Пентагалогениды фосфора РНа15 более просты по структуре, их молекулы имеют форму тригональной бинирамиды, являются… Читать ещё >
Фосфор. Общая и неорганическая химия (реферат, курсовая, диплом, контрольная)
Историческая справка Фосфор был открыт X. Брэндом в 1669 г. Лавуазье много позже доказал, что фосфор — самостоятельный химический элемент. Ж. Л. Пруст и М. Клапрот доказали, что фосфор широко распространен в земной коре, главным образом в виде фосфата кальция. Еще в 1715 г. И. Генсинг установил наличие фосфора в мозговой ткани, а в 1769 г. Ю. Ган доказал, что в костях содержится много фосфора.
Фосфор относится к числу распространенных элементов. Содержание фосфора в земной коре составляет 0,04% от общего числа атомов.
Фосфор, подобно углероду, водороду и азоту, — необходимая составная часть всех живых клеток животных и растений; особенно богаты органическими соединениями фосфора мозг и нервные клетки.
В силу своей химической активности фосфор в природе в свободном виде не встречается. Он встречается главным образом в виде апатитов Са5На1(РО^)3, где Hal — F, реже С1 или ОН; фосфоритов Са8(РО^)2.
Еще в 1924 г. академиком А. Е. Ферсманом были открыты громадные запасы апатитов на Кольском полуострове. Большие запасы фосфоритов находятся в горах Кара-Тау в Казахстане.
Процесс получения фосфора протекает в специальных исчах при температуре электрической дуги и состоит из двух стадий:
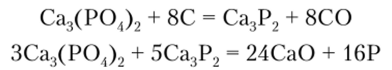
Для ускорения реакции к исходной смеси добавляют Si09, который снижает температуру плавления фосфорита и связывает оксид кальция:
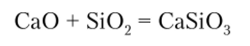
Поэтому суммарная реакция получения фосфора может быть написана в виде уравнения.
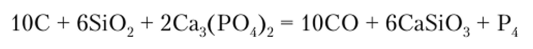
Свойства фосфора и его соединений. Фосфор образует три основные аллотропные модификации: белый, красный и черный фосфор. Наибольшее значение имеет белый фосфор. На воздухе самовоспламеняется, в темноте светится. В жидком, растворенном состоянии, а также в парах ниже 1000 °C устойчивы четырехатомные молекулы Р4, имеющие форму тетраэдра. Получают белый фосфор при быстром охлаждении паров фосфора. Очень ядовит!
В молекуле связи С—С легко разрываются, этим и объясняется высокая химическая активность белого фосфора и склонность переходить в более стабильные полимерные модификации, например в красный. Красный фосфор получают длительным нагреванием белого фосфора без доступа воздуха при 250—300°С. По своим свойствам он отличается от белого: это порошок темно-красного цвета, не ядовит. Существует несколько форм красного фосфора, которые являются полимерными веществами, состоящими из пирамидально связанных атомов. Физические свойства красного фосфора (температура плавления, плотность, цвет) зависят от способов получения. При возгонке красного фосфора в парообразное состояние переходят молекулы Р2, которые при конденсации рекомбинируются в молекулы Р4, т. е. переходят в белый фосфор.
Черный фосфор получают нагреванием белого фосфора при 200 °C под высоким давлением. Эта модификация фосфора имеет атомно-слоистую структуру. По внешнему виду черный фосфор похож на графит, но в отличие от последнего является полупроводником.
Кислородные соединения фосфора более устойчивые, чем азота, а водородные соединения менее прочные по сравнению с аммиаком. Если NH3 можно получить непосредственным синтезом из азота и водорода, то РН3 получают косвенно. Химическая активность фосфора значительно выше, чем азота.
В отличие от азота фосфор легко окисляется кислородом, галогенами и другими сильными окислителями. При взаимодействии фосфора с кислородом воздуха (окисление на воздухе) получаются радикал РО* — фосфорил — и атомарный кислород, который с молекулой 02 образует 03. Процесс окисления сопровождается свечением (хемолюминесценцией): 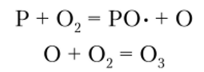
При горении фосфора образуется оксид фосфора (У):
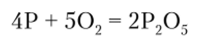
При действии азотной кислоты фосфор окисляется до РО3 :
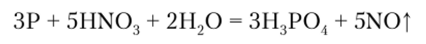
В реакциях с галогенами фосфор может окисляться с образованием РС13 и РС13: 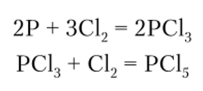
При взаимодействии с металлами образуются фосфиды:
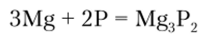
Наряду с этими реакциями фосфор способен и к реакциям диспропорционирования. Так, нагревание фосфора со щелочами приводит к образованию фосфина и соответствующей соли фосфорноватистой кислоты:
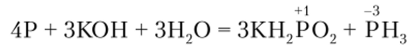
Фосфор в обычных условиях не взаимодействует с водородом, поэтому РН3 получают либо реакцией фосфора со щелочами, либо взаимодействием фосфидов с водой:
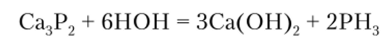
Фосфин РН3 — бесцветный газ, растворим в воде. Очень ядовит! В химическом отношении напоминает NH3, хотя и отличается по ряду свойств.
По аналогии с аммиаком РН3 при нагревании разлагается на фосфор и водород. Реакция обратимая:
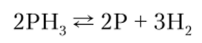
При высокой температуре РН3 загорается с образованием Р205:
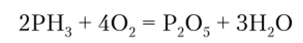
Под действием сильных окислителей происходит окисление фосфина до фосфорной кислоты:
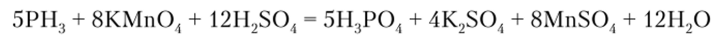
С кислотами фосфин образует соли фосфония:
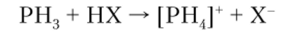
Строение катиона фосфония [ РН4]4 аналогично аммонию [NHJf, но соли фосфония образуются только с очень сильными безводными кислотами.
Соединения фосфора с металлами следует рассматривать как соли РН3 (Н3Р), хотя он обладает весьма слабыми кислотными свойствами.
В соединениях с галогенами фосфор может проявлять степень окисления +3 и +5 (РС13 и РС15). Тригалогениды фосфора, кроме PF3, получают прямым галогенированием. При избытке хлора, как это было показано, образуется РС15. В соединениях Р3+ в образовании связей принимают участие три или четыре л^-гибридные орбитали атома фосфора, вследствие чего связи располагаются либо пирамидально, либо тетраэдрически. Так, молекула РС13 представляет собой тригональную пирамиду с атомом С в вершине:
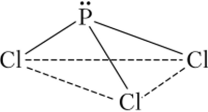
В ряду галогенидов PF3 — РС13 — РВг3 — Р13 устойчивость молекул падает.
Тригалогениды являются донорами электронной пары, поэтому легко вступают во взаимодействие с акцепторами электронов по донорно-акцепторному механизму:
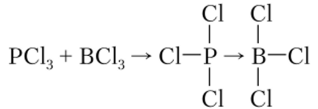
PF3 — бесцветный, ядовитый газ. Он образует с переходными металлами такие же комплексы, как и СО. В отличие от других тригалогенидов PF3 не обладает свойствами кислот Лыоиса, поэтому гидролиз его происходит медленно.
РС13 — легко кипящая жидкость, энергично гидролизуется до фосфористой кислоты и легко окисляется кислородом до РОС13:
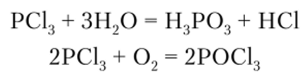
Пентагалогениды фосфора РНа15 более просты по структуре, их молекулы имеют форму тригональной бинирамиды, являются типичными кислотными соединениями. Так, они гидролизуются до соответствующих кислот, а в неводной среде легко реагируют с основными фторидами:
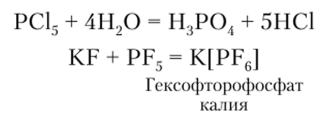
В среде жидкого HF образуется неустойчивая гексафторфосфорная кислота HPF6:
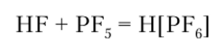
Из пентагалогенидов фосфора соединение с иодом неизвестно. PF5 — бесцветный газ, РС15 и РВг5 — твердые вещества. В парах РВг5 полностью диссоциирован на РВг3 и Вг2.
Кроме производных какого-либо одного галогена, известны смешанные галогениды, например PF3C12. Устойчивость подобных галогенидов меньше, поэтому при нагревании они разлагаются: