Реакции обнаружения катионов третьей аналитической группы

Описание опыта. К 2—3 каплям раствора соли никеля прибавляют 3—5 капель гидроксида аммония и 2—3 капли 1%-ного спиртового раствора диметилглиоксима. Это наиболее характерная и чувствительная реакция на ион никеля. Выполнению ее мешает катион железа (П), дающий с реактивом Чугаева соединение красного цвета. Однако его можно связать в малорастворимое соединение действием Na2HP04. В присутствии Fe2… Читать ещё >
Реакции обнаружения катионов третьей аналитической группы (реферат, курсовая, диплом, контрольная)
Третью аналитическую группу составляют катионы Al3+, Сг3+, Fe2+, Fe3+, Mn2+, Zn2+, Ni2+, Co2+ и ряда других менее распространенных элементов. Их сульфиды, в противоположность сульфидам 1-й и 2-й групп, практически нерастворимы в воде (сульфиды хрома и алюминия подвергаются полному и необратимому гидролизу и переходят в нерастворимые гидроксиды). Однако они растворяются в разбавленных кислотах, чем и отличаются от сульфидов катионов 4-й и 5-й групп.
Групповым реагентом является сульфид аммония (NFI4)2S, осаждение которым проводится в присутствии аммонийной буферной смеси при pH 9. В осадок выпадают сульфиды всех катионов 3-й группы, за исключением алюминия и хрома, которые осаждаются в виде гидроксидов.
Кроме того, катионы 3-й группы делятся на две подгруппы: А13+, Сг3+, Fe3+ осаждаются гидроксидом аммония в присутствии солей аммония; остальные катионы остаются в растворе.
Все соли катионов 3-й группы в растворе подвержены гидролизу, а соли алюминия и хрома, образованные слабыми кислотами, гидролизуются практически полностью. Кроме сульфидов, у катионов этой группы нерастворимы в воде гидроксиды, фосфаты и карбонаты.
Алюминий
В водных растворах катион алюминия бесцветен.
Л) Действие группового реагента
Сульфид аммония в присутствии аммонийной буферной смеси осаждает из растворов солей алюминия белый осадок гидроксида алюминия:
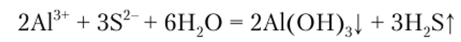
Описание опыта. К 2 каплям раствора соли алюминия прибавляют по 2—3 капли растворов хлорида аммония NH4C1 гидроксида аммония N114OII и сульфида аммония (NII4)2S и наблюдают образование осадка. В силу амфотерного характера гидроксида алюминия осадок его хорошо растворяется как в кислотах, так и в сильных основаниях, чем иногда пользуются для отделения алюминия от других катионов группы.
Б) Реакция с сильньши основаниями
Сильные основания NaOH и КОН при осторожном прибавлении (по каплям) к раствору соли алюминия осаждают его в виде гидроксида:
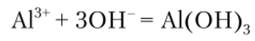
Полное осаждение достигается при pH = 5—10. При меньших или больших значениях pH раствора осадок растворяется.
Описание опыта. Помещают в пробирку 5—6 капель раствора соли алюминия и прибавляют 1 каплю 2 н раствора NaOII. Наблюдают образование белого аморфного осадка.
В) Реакция с гидроксидом аммония
Гидроксид аммония NH4OH подобно сильным основаниям осаждает алюминий в виде гидроксида А1(ОН)3, нерастворимого в солях аммония вследствие малой величины произведения растворимости. Действуя смесью NH4OH и NII4C1, открывают алюминий в присутствии солей цинка. Если в растворе находится ион ЛЮ2 (pH > 10), то перед прибавлением NH4OH его переводят в катион А13 добавляя необходимое количество кислоты:
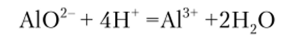
Реакция служит для открытия алюминия при систематическом ходе анализа. Ионы Сг3+ и Fe3" также осаждаются гидроксидом аммония в присутствии солей аммония, образуя Сг (ОН)3 и Fe (OH)3, поэтому их нужно предварительно удалить.
Реакции получения лаков с органическими красителями Ализарин (1,2-диоксиантрахинон СиН602(ОН)2) (а) дает с гидроксидом алюминия малорастворимое соединение ярко-красного цвета (б), называемое алюминиевым лаком:
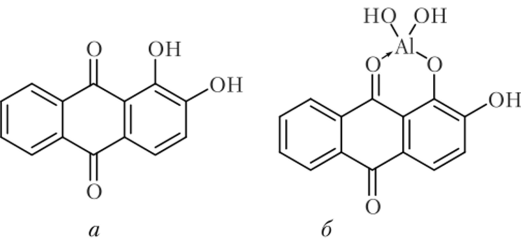
Подобные окрашенные лаки дают с ализарином и другие катионы. Поэтому необходимо отделять их от алюминия. Достигается это следующим образом.
Описание опыта. На полоску фильтровальной бумаги наносят каплю раствора K4[Fe (CN)6]. В центр влажного пятна помещают каплю исследуемого раствора. Если в растворе кроме алюминия присутствуют мешающие реакции катионы (например, Fe3~), то в центре пятна появится осадок малорастворимых гексацианоферратов. Чтобы вымыть из него адсорбированные катионы алюминия, полезно нанести на осадок каплю воды. Обрабатывают бумагу газообразным аммиаком, для чего 1—2 мин держат ее над отверстием склянки с концентрированным аммиаком. Пятно по периферии обводят капилляром с раствором ализарина и снова обрабатывают газообразным аммиаком. При этом не должно оставаться желтого окрашивания, свойственного ализарину в кислой среде. В присутствии катиона алюминия появляется розовое кольцо на фиолетовом фоне. Этот фон представляет собой окраску ализарина в щелочной среде. Красноватая окраска алюминиевого лака становится более отчетливой после подсушивания бумаги.
Эта реакция очень чувствительна и применяется для дробного открытия алюминия в присутствии других катионов.
Алюминон (NH4)3C19H1103(C00)3 — аммонийная соль ауринтрикарбоновой кислоты — образует с гидроксидом алюминия соединение красного цвета:
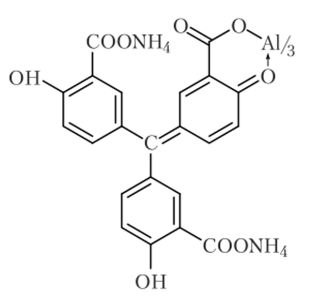
Описание опыта. Для выполнения реакции к 2 каплям раствора соли алюминия добавляют 1 каплю уксусной кислоты, 1—2 капли раствора алюминона и нагревают на водяной бане. Затем прибавляют раствор NH^OH до появления запаха и 2—3 капли раствора (NH4)2C03. Красные хлопья алюминиевого лака доказывают присутствие алюминия.
Реакция очень чувствительна. Следует иметь в виду, что кроме иона алюминия лаки красного цвета с алюминоном образуют Fe3+, Сг3+ и Са2+. Лак, образованный хромом, разрушается действием гидроксида аммония, а образованный кальцием — действием карбоната аммония. Ион железа должен быть предварительно удален действием избытка сильного основания, после чего раствор подкисляют уксусной кислотой.
- Д) Реакция с оксихинолином
- 8-Оксихинолин в присутствии ацетатного буферного раствора (отличие от магния) осаждает алюминий из раствора в виде зеленовато-желтого кристаллического осадка оксихинолята алюминия, растворимого в минеральных кислотах:
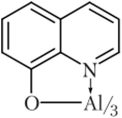
Описание опыта. На фильтровальную бумагу наносят каплю раствора, содержащего ионы алюминия, каплю ацетатного буферного раствора (pH = = 6,5-^9,5) и каплю 0,03%-ного этанолыюго раствора оксихинолина. В присутствии алюминия влажное пятно в ультрафиолетовом свете имеет зеленое свечение.
Хром
Хром образует два ряда устойчивых солей: соли хрома (Ш), содержащие катион Сг3+, и соли хрома (У1), содержащие либо хромат-ион СЮ2", либо бихромат (дихромат)-ион Сг202. Растворы солей хрома (Ш) имеют зеленую или фиолетовую окраску, растворы хроматов — желтую, а растворы бихроматов — оранжевую.
А) Действие группового реагента
Групповой реагент осаждает катион хрома в виде гидроксида хрома Сг (ОН)3 серо-фиолетового или серо-зеленого цвета, обладающего амфотерными свойствами:
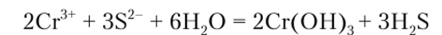
Образующиеся при действии щелочей на осадок Сг (ОН)3 хромиты окрашены в ярко-зеленый цвет. В отличие от алюминатов они необратимо разлагаются при кипячении (гидролиз) с образованием гидроксида хрома:
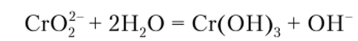
Сильные основания NaOII и КОН, гидроксид аммония NH4OH и соли слабых кислот Na2C03, Na2S03 и др. также осаждают катион хрома (Ш) в виде гидроксида. Убедитесь в этом на соответствующих опытах.
Б) Окисление хрома (Ш) вхром (VI).
Многие окислители (Н202, Na202, С12, КМп04 и т. п.) переводят хром (Ш) в хром (У1). При этом в кислой среде образуются анионы Сг202, а в щелочной — СгО2-. В систематическом ходе анализа предусмотрено окисление иона хрома (Ш) действием пероксида водорода Н202 в щелочной среде:
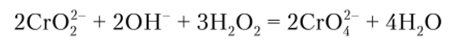
Описание опыта. К 2—3 каплям раствора соли хрома (Ш) прибавляют избыток 2 и раствора гидроксида натрия так, чтобы образовавшийся осадок растворился. Затем приливают 2—3 капли 3%-ного пероксида водорода и нагревают до перехода зеленой окраски раствора в желтую. Раствор подкисляют уксусной кислотой и, действуя хлоридом бария, по образованию осадка хромата бария убеждаются в присутствии аниона СгО2
Хромати бихромат-ионы
A) Образование малорастворимых солей
Хромат-ион СгО2- дает малорастворимые соли с РЬ2+ и Ba2t желтого цвета, Ag~ — кирпично-красного цвета, что может быть использовано для его обнаружения и отделения. Реакцию следует выполнять в присутствии в растворе ацетатной буферной смеси.
Б) Реакция с бензидином
Бензидин CPH8(NH7)2 в присутствии СН3ССЮН окисляется ионами хрома (У1) с образованием продукта, окрашенного в синий цвет.
Описание опыта. Эта реакция обнаружения хрома выполняется капельным методом после окисления катиона хрома до СгО2" действием Н202 или Na202. Каплю полученного при реакции с пероксидом водорода раствора наносят на полоску фильтровальной бумаги и действуют на нее каплей ацетата бензидина. Пятно синеет.
Реакция позволяет обнаружить 0,25 мкг хрома. Предельное разбавление — 1: 200 000. Реакции мешает присутствие в растворе сильных окислителей, также способных окислять бензидин.
B) Образование иадхромовой кислоты
При действии Н202 на подкисленный раствор хромата или бихромата получается надхромовая кислота Н2СгОе, вследствие чего раствор окрашивается в интенсивно синий цвет:
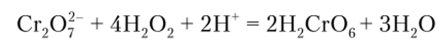
В водном растворе надхромовая кислота очень неустойчива, и синяя окраска быстро переходит в зеленую. Если, однако, к раствору прибавить амиловый спирт или диэтиловый эфир, то при взбалтывании надхромовая кислота переходит в органическую фазу, что сильно повышает ее устойчивость.
Комбинируя описанную реакцию с какой-либо реакцией окисления хрома (Ш) до хрома (У1), можно использовать ее для дробного открытия катиона хрома в присутствии всех остальных катионов 3-й группы.
Железо
Железо образует два ряда устойчивых солей: соли железа (П) и соли железа (Ш). Растворы солей железа (Ш) содержат катион Fe3+ и имеют желтую или красно-бурую окраску, а растворы солей железа (П) — катион Fe2+ и имеют бледно-зеленую окраску.
Железо (Ш) Fe',+
A) Действие группового реагента
Сульфид аммония (NH,)., S в присутствии аммонийной буферной смеси осаждает из растворов железа (Ш) Fe2S3 черного цвета. При растворении сульфида железа (Ш) в кислотах катион Fe3+восстанавливается до Fe2+:
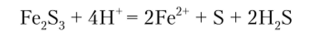
Таким образом, в процессе осаждения катионов 3-й группы групповым реагентом железо (Ш) может быть определено неправильно. Поэтому обнаружение железа проводят дробными реакциями до осаждения остальных катионов групповым реагентом.
Б) Реакция с сильными основаниями
Щелочи NaOH и КОН, а также гидроксид аммония NH4OH осаждают железо (Ш) из раствора его солей в виде красно-бурого аморфного гидроксида Fe (OH)3, нерастворимого в избытке щелочи и солях аммония:
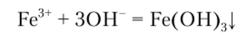
B) Реакция с гексацианоферратом (11) калия.
Гексацианоферрат (П) калия K4[Fe (CN)fJ даете ионом Fe3' темно-синий осадок берлинской лазури:
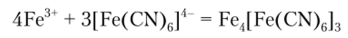
В разбавленной соляной кислоте осадок не растворяется, но растворяется в избытке реагента и разлагается в щелочной среде. Поэтому реакцию проводят в кислом растворе. Ион цинка мешает реакции, так как образует с гексацианоферратом (П) калия белый осадок двойной соли.
Описание опыта. К 1—2 каплям раствора соли железа (Ш) прибавляют столько же соляной кислоты и 2—3 капли раствора K4[Fe (CN)6].
Г) Реакция с тиоционатом (роданидом) калия или аммония
Роданиды NH, SCN или KSCN образуют с катионом Fe3+ комплексы, окрашивающие раствор в кроваво-красный цвет:
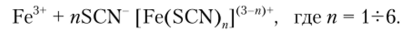
При избытке реактива равновесие этой обратимой реакции смещается вправо и окраска раствора усиливается.
Этой важнейшей и наиболее чувствительной реакции на железо (Ш) мешают щавелевая, винная, фосфорная кислоты, а также фториды, образующие с железом более прочные комплексные соединения.
Железо (И) Fe2+
Д) Действие группового реагента
Сульфид аммония в присутствии аммонийной буферной смеси осаждает из раствора солей железа (П) черный сульфид железа FeS, хорошо растворимый в соляной кислоте:
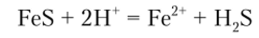
При растворении осадка в концентрированной азотной кислоте железо окисляется до Fe3" :
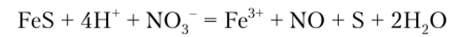
Этим обстоятельством иногда пользуются для последующего отделения железа действием гидроксида аммония.
Е) Реакция с сильными основаниями
Щелочи NaOII или КОН осаждают железо (П) из растворов в виде гидроксида Fe (OH)., грязно-зеленой окраски. Кислород воздуха постепенно окисляет его до Fe (OH)3. Осадок растворим в кислотах.
Гидроксид аммония осаждает Fe2+ не полностью, в присутствии солей аммония осаждения вообще не происходит.
Ж) Реакция с гексациаиоферратом{Х) калия
Гексацианоферрат (1П) калия K3[Fe (CN)6] дает с ионом Fe2+ темно-синий осадок турнбулевой сини:
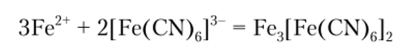
Осадок нерастворим в соляной кислоте, но разлагается сильными основаниями с образованием гидроксида желсза (П). Поэтому реакцию ведут в нейтральной либо слабокислой среде. Реакция чувствительна и чаще других используется для открытия Fe2+.
Описание опыта. К 2—3 каплям раствора соли железа (П) приливают 1—2 капли раствора K3[Fe (CN)G] и наблюдают образование характерного темно-синего осадка.
Марганец
Растворы солей Мп2+ имеют бледно-розовый цвет, едва заметный в большом слое раствора.
А) Действие группового реагента
Сульфид аммония (NH4)2S осаждает из растворов солей Мп2+ осадок сульфида марганца MnS телесного цвета, хорошо растворимый в сильных кислотах с выделением сероводорода.
Б) Реакция с сильными основаниями
Щелочи NaOH и КОН образуют с ионом Мп2+ белый осадок гидроксида маргапца (П) Мп (ОН)2. Последний растворим в кислотах, по не растворяется в избытке щелочи. Кислородом воздуха он постепенно окисляется до бурого гидроксида марганца (1У):
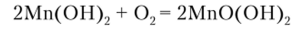
Осадок МпО (ОН), получается также при окислении Мп2+ пероксидом водорода в щелочной среде:
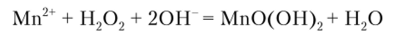
Описание опыта. К 2—3 каплям раствора соли марганца (П) прибавляют несколько капель раствора гидроксида натрия до появления белого осадка Мп (ОН)2. Следует обратить внимание на то, что осадок постепенно буреет вследствие окисления гидроксида марганца (П). Затем прибавляют к осадку 2—3 капли 3%-ного раствора Н202. Осадок сразу же становится буро-черным.
Гидроксид марганца (1У) растворяется в соляной кислоте при нагревании:
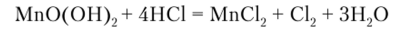
или в серной кислоте в присутствии пероксида водорода:
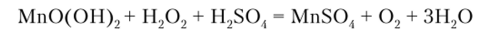
Гидроксид аммония тоже осаждает марганец (П) в виде Мп (ОН)2, но в присутствии солей аммония осадок не образуется.
В) Окисление марганца (11) до МпО, Эта реакция является одной из важнейших для открытия марганца. При окислении марганца до Мп04 раствор окрашивается в характерный малиново-фиолетовый цвет.
Окисление диоксидом свинца РЬ02 проводят в присутствии азотной кислоты и при нагревании:
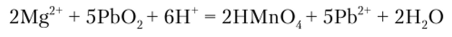
Выполнению реакции мешает избыток соли марганца (П), восстанавливающий анион Мп04 до гидроксида марганца (1У) бурого цвета. Кроме того, по этой же причине в растворе должны отсутствовать и другие восстановители, например ионы СГ.
Описание опыта. В пробирку помещают крупинку диоксида свинца РЬ02, прибавляют 4—5 капель концентрированной азотной кислоты, нагревают, прибавляют 1 каплю раствора сульфата или нитрата (но не хлорида) марганца, перемешивают и снова нагревают на водяной бане. Следует убедиться, что появившаяся окраска иона Мп04 исчезает при добавлении еще 3—4 капель соли марганца. Открываемый минимум реакции — 5 мкгмарганца в 1 мл раствора. Если в испытуемом растворе присутствуют анионы хлора, то их предварительно осаждают несколькими каплями нитрата серебра и образовавшийся осадок хлорида серебра удаляют центрифугированием.
Окисление персульфатом аммония (NH4)2S208:
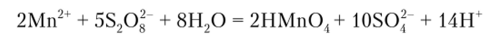
Эту реакцию ведут в присутствии катализатора — нитрата серебра, без которого марганец (П) окисляется до бурого гидроксида МпО (ОН)2. Ионы хлора и другие восстановители мешают выполнению реакции.
Описание опыта. К 5—6 каплям раствора (NH4)2S2Og прибавляют каплю 2 М H., S04, 1—2 капли концентрированной Н;, Р ()4, 1—2 капли раствора AgNO., и нагревают. В нагретую окислительную смесь вносят при помощи стеклянной палочки минимальное количество раствора, содержащего ионы марганца (П) и не содержащего хлорид-ионов, перемешивают и наблюдают окраску перманганат-иона.
Окисление висмутатом натрия NaBiO., протекает по уравнению.
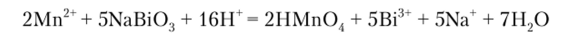
Эта реакция в отличие от изученных ранее идет на холоде, поэтому небольшой избыток соли марганца (П) не мешает.
На холоде анионы хлора реагируют с Мп04 сравнительно медленно, поэтому в первый момент удается наблюдать появление малинового окрашивания раствора даже в присутствии СГ.
Описание опыта. Для выполнения реакции к 1 —2 каплям раствора соли марганца (П) прибавляют 3—4 капли 6 н раствора азотной кислоты и 5—6 капель воды, после чего вносят в раствор немного порошка висмутата натрия. Перемешав, центрифугируют избыток реагента и фиксируют изменение окраски раствора. Эта реакция чрезвычайно чувствительна и очень удобна.
- Г) Реакция с ПАН
- 1-(2-пиридилазо)-2-нафтол (ПАН) (а) образует с ионами марганца (II) при pH = 7—10 малорастворимое в воде комплексное соединение краснофиолетового цвета состава Мп (ПАН)2 с предполагаемой структурой (6):
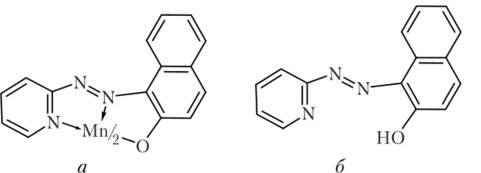
Комплекс экстрагируется СНС13, CGHe, СС14, спиртами. Предел обнаружения марганца — 0,05 мкг. Мешают Fe (III), Co (II), Ni (II), Zn (II) и другие катионы, с которыми ПАН в этих условиях также образует окрашенные комплексные соединения.
Описание опыта. К 2—3 каплям раствора, содержащего ионы марганца (П), добавляют 5—7 капель воды, 4—5 капель 0,1%-ного этанолыюго раствора ПАН, аммиака до pH = 10 и экстрагируют хлороформом. Органическая фаза окрашивается в красный цвет. В отсутствии марганца (П) органическая фаза имеет желтую окраску.
Цинк
Растворы солей цинка бесцветны.
А) Действие группового реагента
Групповой реагент осаждает из растворов солей цинка белый сульфид цинка ZnS, хорошо растворимый в сильных кислотах с выделением сероводорода.
Б) Реакция с основаниями
Щелочи NaOII и КОП дают с ионами цинка белый аморфный осадок гидроксида цинка, растворяющийся в избытке щелочи и в кислотах.
Описание опыта. К 4—5 каплям раствора соли цинка прибавляют сначала 1—2 капли раствора гидроксида натрия, а затем избыток его — до растворения осадка:
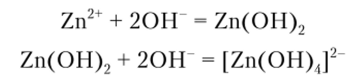
Гидроксид алтония NH4OH также осаждает цинк в виде его гидроксида, который затем растворяется в избытке реагента или при добавлении солей аммония:
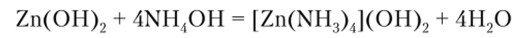
Описание опыта. К 5—6 каплям раствора соли цинка осторожно прибавляют раствор гидроксида аммония и наблюдают образование осадка и последующее растворение его в избытке реагента.
В присутствии солей аммония образование осадка вовсе не происходит.
В) Реакция с сероводородом
Сероводород II2S осаждает ионы цинка в виде белого сульфида, растворимого в сильных кислотах. Поэтому для полного осаждения к раствору прибавляют ацетат натрия.
Описание опыта. К 4—5 каплям раствора соли цинка приливают 2—3 капли раствора ацетата натрия и медленно добавляют сероводород. Реакцию используют в ходе анализа для дробного обнаружения иона цинка в присутствии других катионов третьей группы. Мешает реакции только Fe'*+, поскольку он окисляет сероводород до свободной серы, выпадающей в виде белого осадка, похожего на ZnS. Для удаления мешающего иона в раствор добавляют порошок карбоната кальция СаС03. Реакцию ведут на холоде. Образовавшийся осадок отделяют от раствора, осторожным прибавлением НС1 доводят pH раствора до 2 и обрабатывают раствор сероводородом. Появление белого осадка свидетельствует о наличии иона цинка в растворе.
Г) Реакция с гексацианоферратом () калия
Гексацианоферрат (И) калия K4[Fe (CN)6] образует с ионом цинка белый осадок двойной соли, растворимый в сильных основаниях:
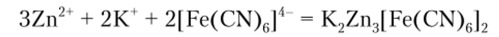
Эта реакция отличает цинк от алюминия, который с рассматриваемым реактивом осадка не образует.
Д) Реакция с гексацианоферратом{) калия
Гексацианоферрат (Ш) калия K3[Fe (CN6)] образует с ионами цинка коричнево-желтый осадок Zn3[Fe (CN)6]2, растворимый в соляной кислоте и гидроксиде аммония:
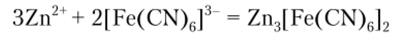
Описание опыта. К 4—5 каплям раствора соли цинка прибавляют 2—3 капли реактива. Следует убедиться, что осадок растворяется в соляной кислоте и гидроксиде аммония.
Е) Реакция с дитизоном
Дитизон (дифенилтиокарбазон (C6H5)N4H2CS), применяемый в виде раствора в хлороформе или тетрахлориде углерода, образует с цинком внутрикомплексную соль, окрашенную в малиново-красный цвет. В отличие от аналогичных соединений других элементов эта соль окрашивает в щелочной среде не только слой органической фазы, но и водный слой. Реакция применяется для дробного обнаружения цинка в присутствии других катионов, в частности всех катионов 3-й группы. Окраску внутрикомнлексной соли необходимо отличать от оранжевой окраски дитизона в щелочной среде.
Описание опыта. Обрабатывают 3 капли исследуемого раствора на часовом стекле 3—4 каплями 2 М NaOH. Каплю полученного щелочного раствора наносят капилляром на фильтровальную бумагу. Пятно обводят по периферии капилляром с раствором дитизона в СС14. Образуется характерное красное кольцо, которое сравнивают с контрольным опытом. Для этого рядом помещают на бумагу каплю 2 М NaOH и также обводят по периферии капилляром с раствором дитизона в СС14. Образуется оранжевое пятно.
Кобальт
Водные растворы солей Со2+ имеют розовую окраску. Вымаривание растворов или добавление дегидратирующих веществ, например этилового спирта, концентрированной серной кислоты и т. п., вызывает переход розовой окраски раствора в синюю.
А) Действие группового реагента
Сульфид аммония в присутствии аммонийной буферной смеси осаждает кобальт (П) из растворов его солей в виде черного осадка сульфида кобальта CoS, который, как п NiS, практически нерастворим в соляной кислоте. Этим обстоятельством иногда пользуются для отделения кобальта и никеля от других катионов 3-й группы.
Растворение CoS и NiS достигается, если действовать на них не только кислотой, но и окислителем, например пероксидом водорода. Реакция идет при нагревании:
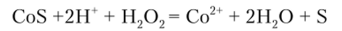
Можно использовать и другие окислители: 6 н азотную кислоту, царскую водку (смесь одного объема концентрированной HN03 с тремя объемами концентрированной НС1) и т. п. Конечно, при этом растворяются и все другие сульфиды и гидроксиды катионов 3-й группы.
Б) Реакция с сильными основаниями и гидроксидом аммония
Гидроксид натрия (или калия) из растворов солей Со2+ выделяет синий осадок основной соли. Например:
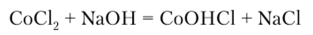
Избыток основания при нагревании переводит CoOlICl в гидроксид кобальта^!) розового цвета: 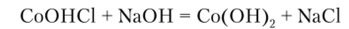
Описание опыта. К 4—5 каплям раствора соли кобальта (И) прибавляют 1 каплю раствора гидроксида натрия. Переводят синий осадок основной соли в розовый Со (ОН)2 действием избытка основания.
Кислород воздуха постепенно окисляет гидроксид кобальта (П) до темно-бурого Со (ОН)3:
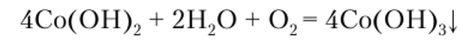
Гидроксид аммония тоже осаждает кобальт (П) в виде основной соли, но его избыток (или соль аммония) растворяет осадок с образованием комплексного соединения желтого цвета:
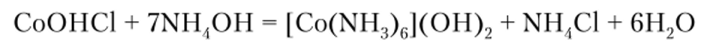
Описание опыта. К 4—5 каплям раствора соли кобальта прибавляют сначала одну каплю гидроксида аммония, а затем избыток его до растворения осадка.
В присутствии солей аммония NH4OH не осаждает ионов кобальта.
В) Реакция с роданидом аммония
Роданид аммония NH4SCN образует с ионом кобальта (Н) комплексный ион синего цвета:
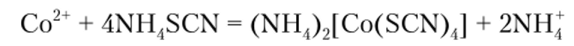
Чувствительность реакции повышается в присутствии амилового спирта (или смеси его с этиловым эфиром), комплексный ион окрашивает спиртовым слой в интенсивно синий цвет.
Описание опыта. К 2—3 каплям раствора соли кобальта приливают 8—10 капель насыщенного раствора роданида аммония (или немного твердой соли) и добавляют 5—6 капель амилового спирта.
Выполнению реакции мешает ион железа (Ш), дающий с роданидами кроваво-красный комплекс. Поэтому ионы железа предварительно связывают в более прочные комплексы действием фторида натрия, винной Н2С4Н406 или ортофосфорной кислоты.
Г) Реакция М. А. Ильинского
Реактив Ильинского (а-нитрозо-р-нафтол C10H6(NO)(OH)) (а) окисляет ион кобальта (Н) до кобальта (Ш) с образованием объемистого краснобурого осадка внутрикомплексной соли Co[C10H6(NO)O]3(6):
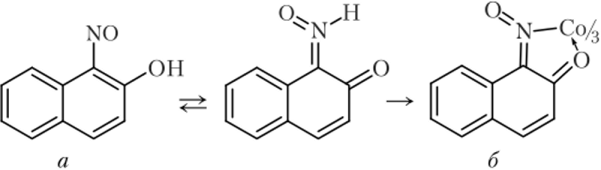
Описание опыта. К 2—3 каплям раствора соли кобальта (П) добавляют 1—2 капли уксусной кислоты, 5 капель свежеприготовленного раствора а-нитрозо-р-нафтола и нагревают на водяной бане. При необходимости трут палочкой о стенки пробирки.
Реакции мешает присутствие в растворе катионов железа (Ш), образующих с реагентом буровато-черный осадок.
Д) Реакция с нитритом калия
Нитрит калия KN02, прибавленный в избытке к нс слишком разбавленному раствору соли кобальта (Н), подкисленному уксусной кислотой, образует желтый кристаллический осадок комплексной соли:
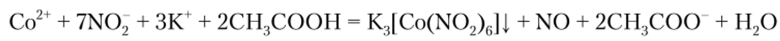
Эта реакция позволяет отличить Со2' от Ni2' и может употребляться для их разделения. В разбавленных растворах осадок появляется при нагревании.
Никель
Водные растворы, содержащие ионы никеля (П), окрашены в зеленый цвет.
A) Действие группового реагента
Сульфид аммония в присутствии аммонийной буферной смеси осаждает никель из растворов его солей в виде черного осадка сульфида никеля NiS, свойства которого совершенно аналогичны свойствам сульфида кобальта.
Б) Реакция с сильными основаниями и гидроксидом аммония
Гидроксид натрия или калия осаждает никель из растворов в виде зеленого осадка гидроксида никеля, растворимого в кислотах:
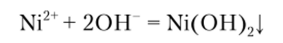
Гидроксид аммония образует зеленый осадок основной соли. При его избытке получается комплекс интенсивного синего цвета:
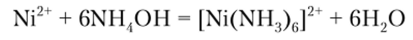
В присутствии солей аммония ион никеля не осаждается.
B) Реакция Л. А. Чугаева
Диметилглиоксим [CH3CNOH]2 осаждает никель из растворов в виде кристаллического ало-красного осадка внутрикомнлексной соли, нерастворимой в минеральных кислотах:
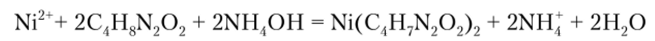
Описание опыта. К 2—3 каплям раствора соли никеля прибавляют 3—5 капель гидроксида аммония и 2—3 капли 1%-ного спиртового раствора диметилглиоксима. Это наиболее характерная и чувствительная реакция на ион никеля. Выполнению ее мешает катион железа (П), дающий с реактивом Чугаева соединение красного цвета. Однако его можно связать в малорастворимое соединение действием Na2HP04. В присутствии Fe2+ реакцию ведут капельным методом. На фильтровальную бумагу наносят кайлю гидрофосфата натрия, затем каплю испытуемого раствора и снова каплю Na2HP04. При этом малорастворимые фосфаты, например FePO^, остаются в центре пятна, а более растворимый фосфат никеля перемещается к его периферии. Полученное пятно обводят по краю капилляром с раствором диметилглиоксима и обрабатывают бумагу парами аммиака. Если в растворе присутствует катион никеля, наблюдается появление розового кольца или (при большом количестве никеля) розовое окрашивание всего пятна.
Результаты действия важнейших реагентов на катионы 3-й аналитической группы приведены в табл. 3.5.
Таблица 35
Реакции катионов 3-й группы
Реагенты. | Катионы. | |||||||
А13+ | Сг3+ | Fe3+ | Fe2+ | Мп2+ | Zn2+ | Со2+ | Ni2*. | |
(NH4)2s +. + NH,()H + + NH, C1. | Белый осадок AI (ОН),. | Серо-зеленый или серо-фиолетовый осадок. | Черный осадок Fe2S3 | Черный осадок FeS. | Осадок телесного цвета MnS. | Белый осадок ZnS. | Черный осадок CoS. | Черный осадок. |
NiSH2S +. + НСООН + + HCOONH4 | Молочно-белый осадок S. | Белый осадок ZnS. | ||||||
NaOH, KOH,. nh4oh. | Белый осадок А1 (ОН)3 | Серо-зеленый или серо-фиолетовый осадок. | Бурый осадок Fe (OH)3 | Зеленоватый буреющий осадок. Fe (OH),. | Белый буреющий осадок Мп (ОН),. | Белый осадок Zn (OH),. | Синий осадок основных солей переменного состава. | Зеленоватый осадок. Ni (OH)2 |
NaOH или КОН в избытке при нагревании. | Бесцветный раствор алюминатов. | Изумруднозеленый раствор хроматов. | Бурый осадок Fe (OH)3 | Зеленоватый буреющий осадок. Fc (OH)2 | Белый буреющий осадок Мп (ОН)2 | Бесцветный раствор | Розовый осадок Со (ОН)2 | Зеленоватый осадок. Ni (OH)2 |
Н202 в щелочной среде при нагревании. | Бесцветный раствор | Раствор желтого цвета. | Бурый осадок Fe (OH)3 | Бурый осадок Fe (OH)3 | Бурый осадок Мп (ОН)4 | Бесцветный раствор | Темно-бурый осадок Со (ОН)з. | Зеленоватый осадок. Ni (OII)2 |
NH4OH в избытке в присутствии солей аммония. | Белый осадок А1 (ОН)з. | Серо-зеленый или серо-фиолетовый осадок. | Бурый осадок Fe (OH)3 | *. | *. | Бесцветный раствор | Оранжево-бурый раствор | Раствор сиреневого цвета. |
CH3COONa при нагревании. | Осадок основных солей белого цвета. | Бурый осадок. | ||||||
Окончание табл. 3.5
Реагенты | Катионы | |||||||
АГ | Cr3f | Fe3+ | Fe2+ | Мп2+ | Zn2+ | О о м. | Ni2* | |
Na, CO. j, к, со,; (NH4)2C03 | Белый осадок А1(ОП)3 | Серо-зеленый или серо-фиолетовый осадок | Бурый осадок Fe (OII):! | Белый буреющий осадоккарбоната FeC03 | Белый осадок МпС03 | Белый осадок основного карбоната | Синий осадок основного карбоната | Зеленый осадок NiC03 |
Na2HP04 | Белый осадок А1Р04 | Зеленый осадок СгР04 | Желтоватый осадок FeP04 | Белый осадок Ре3(РО,)2 | Белый осадок Мп3(РО,)2 | Белый осадок Zn3(PO")2 | Фиолетовый осадок | Зеленый осадок Ni3(PO,)2 |
KJFe (CN)fJ | — | — | Синий осадок | Белый осадок | Белый осадок | Белый осадок | Зеленый осадок | Бледно-зеленый осадок |
K,[Fe (CN)6] | — | — | — | Синий осадок | Бурый осадок | Желтый осадок | Темно-красный осадок | Желто-бурый осадок |
Окислители в щелочной среде | Бесцветный раствор | Раствор желтого цвета | Бурый осадок Fe (()H)3 | Бурый осадок Fc (()H)3 | Бурый осадок | Бесцветный раствор | Темно-бурый осадок | Черный осадок Ni (()H)3 |
Окислители в кислой среде | Раствор оранжевого цвета | Малиново фиолетовый раствор | ||||||
* Из раствора постепенно осаждаются продукты окисления Fe (OH)3 и МпО (ОН)2.