Относительная сила кислот

Кислоты, в которых содержится несколько гидроксидных групп, т. е. кислоты, способные диссоциировать с образованием нескольких про гонов, называются многоосновными. Диссоциация многоосновных кислот Н"А осуществляется ступенчато. Наиболее легко отщепляется первый протон: Число негидроксидных атомов кислорода уменьшается от трех до нуля и происходит переход от сильнейшей хлорной кислоты к очень… Читать ещё >
Относительная сила кислот (реферат, курсовая, диплом, контрольная)
Кислоты, в которых содержится несколько гидроксидных групп, т. е. кислоты, способные диссоциировать с образованием нескольких про гонов, называются многоосновными. Диссоциация многоосновных кислот Н"А осуществляется ступенчато. Наиболее легко отщепляется первый протон:
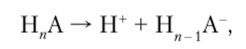
так как он отрывается от нейтральной молекулы, труднее — второй, отрывающийся от однозарядного аниона:
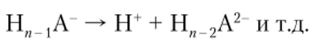
Очевидно, что протонная теория позволяет количественно характеризовать силу кислот и оснований в водных растворах с помощью тех же констант Ка и КЬу что и теория Аррениуса. Последовательные константы кислотной диссоциации обозначают соответствующими индексами — К1(Г К1а1 и т. д. Они составляют быстро убывающий ряд: обычно отношение последовательных констант близко к 10-5. Например, для ортофосфорной кислоты Н3Р04 К = 7,5 • 10 3, К" = 6,2 • 10-8 и К™ = 1 • 1012.
Аналогичные соотношения наблюдаются и для многокислотных оснований, т. е. оснований, способных присоединять более одного протона.
Относительная сила кислот связана с их способностью отщеплять протон. Для бескислородных кислот НА способность отщеплять водородный ион определяется полярностью и энергией связи Н—А. Например, в ряду HF—НС1 — HBr—HI энергия связи падает, а кислотность растет несмотря на уменьшение полярности связи. В ряду же СН4 — NH3 — Н20 — HF, несмотря на упрочнение связи, кислотность увеличивается с ростом электроотрицательности атома, с которым связан водород.
В случае кислородсодержащих кислот наибольшее значение имеет полярность связи Н—О, которая в свою очередь зависит от природы центрального атома и числа негидроксидных атомов кислорода в молекуле. Роль негидроксидных атомов кислорода в молекуле кислоты заключается в их способности оттягивать на себя электронную плотность со связей Н—О (поляризационный эффект). Чем больше негидроксидных атомов кислорода, тем сильнее кислота. Так, в ряду 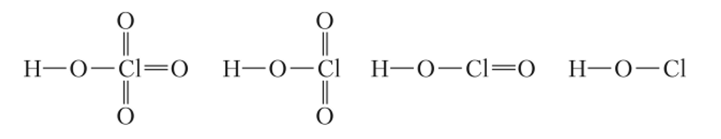
число негидроксидных атомов кислорода уменьшается от трех до нуля и происходит переход от сильнейшей хлорной кислоты к очень слабой (Ка = 3,2 • 10 8) хлорноватистой (этот и другие примеры вы еще встретите в гл. 19—24, посвященных химии р-элементов).
В зависимости от числа негидроксидных атомов кислорода можно разделить все кислородсодержащие кислоты на четыре класса.
- 1. Нет негидроксидных атомов кислорода — очень слабые кислоты НнАО", Ка < 10 7, например НС10, НВгО, НЮ, Н3В03, H4Si04, Н6Те06.
- 2. Один негидроксидный атом кислорода — слабые кислоты Н"АОл+1, Ка * 10 2, например НС102 (Ка = 1,1 10 2), H2S03 (К] = 1,2 -10 2), Н3Р04 (/С'=0,75−10 2).
- 3. Два негидроксидных атома кислорода — сильные кислоты НпАО,1+2, К ~ 10:!, К" * 10 2, например H2S04 (К" = 1,2−10 2).
- 4. Три негидроксидных атома кислорода — очень сильные кислоты, например НСЮ4, НМп04.
В табл. 14.1 приведены константы К(1 и Кь для некоторых кислот и оснований.
Таблица 14.1
Константы диссоциации для некоторых кислот и оснований.
Кислота. | Уравнение диссоциации. | K. |
Азотистая. | HN02 5=t н+ + no2 | 4,0 10 4 |
Серная. | H2S04 5=s н+ + hso4— HS04 I-r + so2 | 0,63−1 O' 1,2−10 2 |
Сернистая. | II2SO, H* + I ISO, HS03 H* + SO2; |
|
Сероводородная. | H2S ^ H+ + HS; HS4 5=t H" + S2; | U-10-7 1,0−10 14 |
Угольная. | H2CO, ^H* + HCO, HCOj 5^ H* + CO2; | 4,5 -10″ 7 4,8−10-«. |
Уксусная. | CH3COOH 5=t 1 Г + CH3COO. | 1,8−10 5 |
Фтороводородная. | HF 5^ H+ + F. | 6,2 10 4 |
Основание. | Уравнение диссоциации. | |
Аммиак. | NH3 + H20 s=* NH4+ + OH. | 1,8 -10 5 |
Гидроксиламин. | NH2OH <=* NH2+ + OH. | 8,9 -lO 9 |
Фосфин. | PH, + H20 PH4+ + OH. | MO28 |
В целом протонная теория позволяет вполне удовлетворительно ин терпретировать кислотно-основные свойства протонсодержащих кислот и сопряженных им оснований.