Люминесцентные методы.
Аналитическая химия

Спектр флуоресценции зеркально симметричен спектру поглощения вещества {правило Левшина), но сдвинут по отношению к последнему в длинноволновую область (закон Стокса и Ломмеля). Это означает, что испускаемый сигнал измеряется относительно действительно нулевого значения интенсивности излучения, что обеспечивает высокую чувствительность люминесцентного метода. Поэтому особенно интересно применение… Читать ещё >
Люминесцентные методы. Аналитическая химия (реферат, курсовая, диплом, контрольная)
Общая характеристика люминесценции
Люминесценция определяется как свечение вещества, возникающее после поглощения им энергии возбуждения, причем оно представляет собой избыточное излучение по сравнению с тепловым излучением вещества при данной температуре. Поэтому виды люминесценции вполне естественно классифицировать по внешнему источнику возбуждения (табл. 10.1).
Таблица 10.1
Виды люминесценции.
Источник возбуждения. | Вид люминесценции. |
Электромагнитное излучение УФ и видимого спектрального диапазона. | Фотол юм и несцен ция. |
Поток электронов (катодные лучи). | Катодолюминесценция. |
Поток ионов щелочных металлов в вакууме. | Ионолюминесценция. |
Рентгеновское излучение. | Рснтгенолюминссцснция. |
Радиоактивное излучение. | Радиолюминесценция. |
Тепловая энергия. | Термолюминесценция или кандолюминссцснция. |
Ультразвук. | Сонолюминесценция. |
Механическое воздействие. | Триболюм и несцен ция. |
Энергия химических реакций. | Хем ил юм и несцен ция. |
В аналитической практике наиболее часто используют фотои хемилюминесценцию.
Люминесцентные методы анализа отличаются большой чувствительностью: для большинства определяемых соединений пределы обнаружения не превышают 10 ! мкг/мл. В идеальных условиях (высокие значения квантового выхода люминесценции и молярного коэффициента поглощения энергии возбуждения, отсутствие поправки на контрольный опыт и т. п.) предел обнаружения может быть на уровне пикограмм в миллилитре. Например, в модельных экспериментах с родамином 6Ж, сорбированном на частицах оксида кремния диаметром 10 мкм, удалось зафиксировать присутствие порядка 8000 молекул (-6−10 18 г) на поверхности одной частицы.
Высокая чувствительность определения и в ряде случаев большой диапазон определения содержания (иногда до четырех порядков величин концентраций) при той же воспроизводимости результатов анализа, что и в молекулярной абсорбционной спектроскопии, предопределили развитие люминесцентных методов анализа.
Рассмотрим подробнее процессы, происходящие в молекуле при активации ее светом. Если молекула диамагнитна, то в невозбужденном состоянии ее электроны находятся в основном синглетном[1] состоянии (на синглетном уровне 50) (рис. 10.1).
Поглощение света молекулой переводит ее из основного в возбужденное синглетное состояние, т. е. один из электронов, поглощая квант света, переходит на более высокий синглетный уровень (5, S2, S3 и т. д.) без изменения спина. Электрон, оказавшийся на высоких синглетных уровнях S2, S3,…, Sn за время порядка 10 11 с попадает на первый возбужденный синглетный уровень S,. Этот процесс потери энергии электроном не сопровождается излучением света и называется внутренней конверсией. Для электрона, попавшего на этот уровень, имеются три возможности (см. рис. 10.1): либо безизлучательный переход на основной уровень, либо гот же переход, но с излучением кванта света, либо безизлучательный переход на первый возбужденный триплетный[2] уровень 1 (интеркомбинационная конверсия).
Излучение, возникающее при переходе молекулы из возбужденного синглетного состояния в основное, называется флуоресценцией.
Процесс интеркомбинационной конверсии сопровождается изменением спина электрона и поэтому маловероятен. Однако из-за высокой кон;

Рис. 10.1. Схема возможных переходов электрона в молекуле при возбуждении ее светом:
1 — переход электрона с основного на возбужденный синглетный уровень; 2 — безизлучательный переход электрона на первый возбужденный синглетный уровень (внутренняя конверсия); 3 — безизлучательный переход электрона с первого возбужденного синглетного на основной синглетный уровень (внутренняя конверсия); 4 — переход электрона с первого возбужденного синглетного на основной синглетный уровень с излучением света (флуоресценция); 5 — безизлучательный переход электрона па первый возбужденный триплетный уровень (интеркомбинационная конверсия); 6 — безизлучательный переход электрона с первого возбужденного триплетного на основной синглетный уровень (интеркомбинационная конверсия); 7 — переход электрона с первого возбужденного триплетного на основной синглетный уровень с излучением света (фосфоресценция) центрации возбужденных молекул часть из них все-таки оказывается в возбужденном триплетном состоянии. С первого возбужденного триплетного состояния электрон может попасть на основной синглетный уровень либо без излучения света (интеркомбинационная конверсия), либо испустив квант света.
Излучение, возникающее при переходе молекулы из возбужденного триплетного состояния в основное синглетное, называется фосфоресценцией.
Процессы перехода электрона с триплетного на синглетный уровень также протекают с изменением спина, поэтому время жизни молекулы в возбужденном триплетном состоянии значительно больше времени ее жизни в синглетном возбужденном состоянии (10 3—103 с — для триплетного и 10 9—10 / с — для синглетного состояния). Соответственно, длительность фосфоресценции значительно (на несколько порядков) превышает таковую для флуоресценции.
Спектр флуоресценции зеркально симметричен спектру поглощения вещества {правило Левшина), но сдвинут по отношению к последнему в длинноволновую область (закон Стокса и Ломмеля). Это означает, что испускаемый сигнал измеряется относительно действительно нулевого значения интенсивности излучения, что обеспечивает высокую чувствительность люминесцентного метода. Поэтому особенно интересно применение этого метода для биохимических систем. В комбинации с чувствительностью и селективностью биохимических реакций он позволяет определять исключительно низкие концентрации вещества.
Количественное определение содержания вещества проводят по интенсивности люминесценции. Зависимость интенсивности флуоресценции /фл от концентрации определяемого вещества описывается уравнением.
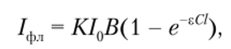
где К — коэффициент пропорциональности; /0 — интенсивность света, использующегося для возбуждения молекул определяемого вещества (так называемого актиничного[3] излучения); В — квантовый выход люминесценции (< 1); е — молярный коэффициент поглощения света; С — концентрация определяемого компонента; / — толщина слоя поглощающего вещества.
Если гС1 1, то /фл «К10ВгС1» аС> где а — константа для данных условия измерения. Эта зависимость является математическим основанием для количественного люминесцентного анализа. Линейная зависимость интенсивности люминесценции от концентрации часто сохраняется в пределах 3—4 порядков величин концентраций. При количественном люминесцентном анализе используются стандартные методы: метод стандартов, метод калибровочного графика и метод добавок.
Пример 10.1. Анализируемый раствор урана объемом 0,05 мл высушен и сплавлен со 100 мг смеси NaF и NaKC03 (9: 91). Рассчитаем концентрацию урана в растворе по следующим данным определения его люминесцентным методом: относительная люминесценция сплава составляла 38% от люминесценции стандарта, содержащего 0,50 мкг урана.
Решение. Содержание урана в пробе составляет
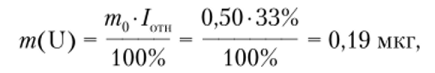
где т0 — содержание урана в стандарте; /ОТ11 — относительная интенсивность люминесценции пробы.
Концентрация урана в пробе (мкг/мл) определяется, но формуле  где V — объем раствора.
где V — объем раствора.
Пример 10.2. При люминесцентном определении концентрации А13+ в дистиллированной воде к 5 мл этой воды добавлен сульфосалицилаль-о-амидофенол и вода до 10 мл. В аналогичных условиях приготовлены растворы известной концентрации алюминия. При измерении интенсивности люминесценции растворов получены следующие результаты:
Су мкг А1. | 0,04. | 0,06. | 0,08. | X |
Интенсивность /л |
Рассчитаем концентрацию алюминия в воде.
Решение. По данным, приведенным в условии примера, строим калибровочный график зависимости интенсивности люминесценции от содержания алюминия в стандартных растворах (рис. 10.2).

Рис. 10.2. Калибровочный график зависимости интенсивности люминесценции от содержания ионов алюминия в растворе
По калибровочному графику для интенсивности люминесценции пробы, равной 19, находим содержание алюминия в пробе, которое составляет 0,067 мкг. Тогда концентрация ионов алюминия в воде будет равна
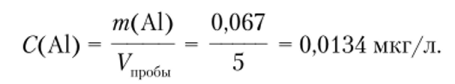
Величина квантового выхода зависит от длины волны актиничного излучения, концентрации определяемого компонента, температуры, наличия в системе веществ — тушителей[4] люминесценции.
Фотолюминесценция наблюдается только тогда, когда энергия кванта актиничного излучения достаточна для перевода молекулы в возбужденное состояние. Поэтому для актиничного излучения должно выполняться условие.

где X — длина волны актиничного излучения; h — постоянная Планка; с — скорость света в вакууме; ESx — ESo — энергия перехода электрона на первый возбужденный синглетный уровень.
На практике длину волны актиничного излучения выбирают исходя из спектра поглощения определяемого компонента либо продукта его взаимодействия с соответствующим реагентом. Спектр поглощения обычно имеет ряд максимумов, отвечающих такой длине волны света, при которой энергия фотона достаточна для перевода электрона в молекуле на более высокий уровень. Очевидно, что длина волны актиничного излучения должна быть не больше той величины, которая отвечает соответствующему максимуму на спектре поглощения.
С ростом концентрации компонентов системы начиная с некоторой величины квантовый выход уменьшается, что объясняется повышением вероятности дезактивации возбужденных молекул невозбужденными молекулами того же вещества (концентрационное тушение). Аналогичное влияние на величину квантового выхода оказывает и повышение давления, которое эквивалентно повышению концентрации всех компонентов системы. Поэтому для люминесцентного анализа существует верхняя граница определяемых концентраций.
С повышением температуры увеличивается частота столкновений частиц в системе. Из-за этого снижаются время жизни возбужденных молекул и, соответственно, квантовый выход.
Зависимость квантового выхода от содержания в системе веществ — тушителей люминесценции позволяет использовать люминесцентный метод также в том случае, когда определяемое вещество само не люминесцирует, но является эффективным тушителем. В этом случае количественный анализ проводят по величине уменьшения интенсивности люминесценции в присутствии определяемого компонента. Влияние тушителей на интенсивность флуоресценции описывается уравнением Штерна — Фольмера
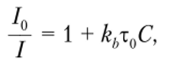
где /0, 1 — интенсивность флуоресценции при отсутствии и в присутствии тушителя соответственно; kh — бимолекулярная константа реакции тушения; т0 — время жизни возбужденной молекулы в отсутствие тушителя; С — концентрация тушителя.
Люминесцентный метод применяется в основном для анализа растворов. Он широко используется при определении органических полициклических ароматических соединений, таких как антрацен, бензпирен и т. п. Из неорганических веществ собственной флуоресценцией обладают только уран и некоторые редкоземельные элементы. Поэтому при определении неорганических соединений их обычно переводят в комплексы с соответствующими органическими соединениями, обладающими интенсивной флуоресценцией и селективно реагирующими с определяемым ионом. Иногда неорганические соединения определяются, но тушению флуоресценции. Газы также в основном определяются, но тушению люминесценции. Например, сильными тушителем флуоресценции является кислород и озон. Известны методы определения озона, в которых он окисляет до исходного состояния предварительно восстановленный флуоресцирующий реагент, например флуоресцеин. При этом количество образовавшейся люминесцирующей формы реагента пропорционально количеству озона.
Чувствительность флуоресцентного метода составляет для разных веществ 1—0,0005 мкг/мл. Верхний предел определяемых концентраций — 10 J моль/л. Селективность достаточно хорошая. Например, при определении озона удается обеспечить абсолютную селективность.
Особенностью аппаратного оформления является необходимость использования двух монохроматоров (один — для актиничного излучения, второй — для люминесцентного излучения) и чувствительных фотоприемников. При этом фотонриемник по отношению к источнику возбуждения люминесценции может располагаться:
- а) иод прямым углом;
- б) фронтально, т. е. находиться по одну сторону с источником возбуждения относительно анализируемого образца;
- в) в линию, т. е. на одной прямой с источником возбуждения, но по разные стороны от анализируемого образца.
Наиболее распространен первый метод. Его преимущество заключается в минимальной фоновой засветке фотоириемника. Однако он пригоден для анализа только слабо поглощающих растворов. Для сильно поглощающих растворов и твердых веществ спектры возбуждения и люминесценции существенно искажаются за счет эффекта нерепоглощения света. При фронтальном расположении фотоириемника это эффект сказывается в меньшей степени. Расположение в линию используют достаточно редко, в основном для исследования сильно поглощающих растворов.
Хемилюминесценция чаще всего является результатом окисления некоторых веществ, как правило, под действием озона, кислорода или пероксида водорода. При этом один из продуктов реакции оказывается в возбужденном состоянии. Переход молекулы или иона из возбужденного в основное состояние сопровождается излучением света. Самым известным примером реакции подобного рода служит реакция окисления люминола пероксидом водорода:
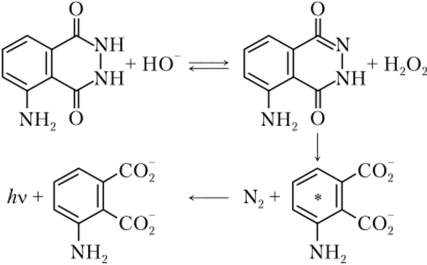
Люминол можно непосредственно использовать для определения содержания озона, кислорода или пероксида водорода, либо веществ, с которыми взаимодействуют эти реагенты, например глюкозы, при окислении которой под действием глюкозооксидазы одним из компонентов реакции является Н202. Кроме того, люминол может использоваться в качестве метки при некоторых вариантах иммуноанализа.
Неорганический хемилюминесцентный анализ основан на способности элементов с незаполненной ^/-оболочкой тушить люминесценцию, катализировать или, реже, ингибировать хемилюминесцентную реакцию. Но эти методики, как правило, не обладают высокой селективностью. Большей селективностью при высокой чувствительности (предел обнаружения — до 10 1 мг/м3) характеризуются хемилюминесцентные методики газового анализа: определение озона, оксидов азота и аммиака после его перевода в N0. Реакции.

в газовой фазе сопровождаются достаточно интенсивной хемилюминесценцией с максимумом при 800 нм.
Для регистрации хемилюминесценции не нужны монохроматор и, что самое главное, внешний источник возбуждения. Измерение относительно абсолютного нуля (отсутствие сигнала в контрольном опыте) делает хемилюминесцентный анализ очень чувствительным.
В целом к несомненным достоинствам люминесцентного метода следует отнести высокую чувствительность и селективность.
К недостаткам относятся существование верхнего предела определяемых концентраций, необратимость реакций реагента с определяемым компонентом в большинстве методик, чувствительность результатов анализа к присутствию неконтролируемых примесей, необходимость температурного контроля, сложность аппаратурного оформления.
- [1] Синглетное состояние — это состояние молекулы, атома, иона, в котором суммарныйспин электронов равен нулю.
- [2] Триплетным называется состояние молекулы, атома, иона, в котором суммарный спинэлектронов равен 1.
- [3] Актиничным называется излучение, использующееся для возбуждения фотолюминесценции.
- [4] Некоторые вещества, будучи введенными в систему, могут взаимодействовать с возбужденной молекулой, дезактивируя се без излучения света. Такие вещества называются тушителями люминесценции.