Химия экстремальных состояний

Этот раздел химии зародился в 1895—1896 гг., когда А. Беккерель обнаружил почернение фотографической пластинки в темноте под действием проникающего излучения солей урана. Работы, связанные с созданием и эксплуатацией ядерных реакторов, потребовали с середины XX в. изучения воздействия ионизирующих излучений на различные материалы. Химики установили закономерности радиационно-химических реакций… Читать ещё >
Химия экстремальных состояний (реферат, курсовая, диплом, контрольная)
Вопросы энергетической активизации реагента исследует химия экстремальных состояний, в составе которой выделяют:
- • химию высоких температур;
- • электрохимию;
- • плазмохимию;
- • радиационную химию; и др.
Химия высоких температур.
Химия высоких температур исследует химические процессы в диапазоне 300—3000°К. Диапазон более высоких температур — 3000—5000°К — изучает плазмохимия[1].
Металлургию нередко называют неорганической химией высоких температур. Обычная природная форма существования металлов — окислы или сульфидные соединения. При высоких температурах горения металл освобождается от кислорода путем присоединения 02 к малоценному химическому элементу, отправляемому в шлак. На ранних ступенях цивилизации не удавалось выделить железо из руды даже на самых жарких кострах, хотя уже были разработаны технологии выплавки меди, олова и др. Железо удавалось выплавлять уже в III тысячелетии до н.э. лишь тогда, когда железную руду смешали с древесным углем, а температуру пламени повышали продуванием воздуха через горящую смесь с помощью кузнечных мехов.
Верхний слой выплавляемого железа в результате пропитки углеродом образовывал сталь — сплав железа с углеродом (содержание углерода в стали менее 1,7%). И в настоящее время кислород воздуха обязательно продувается через расплавленный металл для повышения температуры горения при производстве стали. Вначале в доменных печах получают чугун с содержанием углерода более 1,7%. Чугун прочен, но хрупок. Затем в мартеновских печах или бессемеровских конверторах из чугуна выжигают углерод за счет реакции углерода с добавлением высших оксидов железа. Для изменения жаропрочности, вязкости, твердости сталей одновременно вводят легирующие добавки: хром, никель, ванадий, вольфрам, марганец.
Электрохимия. Один из первых примеров успеха электрохимии — производство алюминия. В романе Н. Г. Чернышевского «Что делать?» при описании городов будущего в качестве образцов технического прогресса упоминаются дома из алюминия: в середине XIX в. алюминий был таким дорогим, что из него делали только очень редкие предметы, например игрушки для наследников престола [2]. И лишь в 1886 г. обнаружили, что природный глинозем (оксид алюминия) растворяется в расплавленном минерале — криолите, а из раствора можно выделить чистый алюминий путем электролиза. Сегодня алюминий настолько дешев, что идет на производство разнообразных товаров массового потребления — от упаковочной фольги до легкой кухонной посуды.
Электрохимия стала бурно развиваться сразу же после создания химического источника электрической энергии — вольтова столба. Химические превращения происходят потому, что внешний источник напряжения как бы перебрасывает электроны от анода к катоду: па катоде (положительном полюсе) происходит присоединение электронов — реакция восстановления, а на аноде (отрицательном полюсе) — отдача электронов — реакция окисления. В растворах химические превращения реализуются за счет того, что ток переносится ионами. Катод справедливо считается самым сильным восстановителем, а анод — самым сильным окислителем, поскольку на эти электроды можно подавать такое сильное напряжение, какое требуется для проведения реакции.
В простейшем примере (рис. 13.3) в воде растворяется соль (NaCl). Ионы СИ притягиваются положительно заряженным электродом (в данном случае атомами углерода), а ионы Na+ — отрицательно заряженным электродом (атомами железа). Натрий оседает в твердой форме на поверхности, а хлор испаряется.
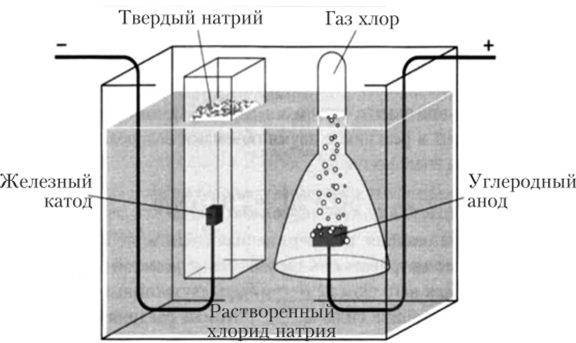
Рис. 133. Схема электролиза1
Само существование гальванических элементов обусловлено химическими процессами: это такие источники тока, которые преобразуют химическую энергию в электрическую.
Английский химик Г. Дэви (1778—1829) путем электролиза разложил щелочи и впервые получил из их расплавов новые элементы — барий, стронций, кальций, магний, калий и натрий. М. Фарадей решил многие теоретические проблемы электролиза, сформулировав, в частности, основной закон электролиза', количество выделившегося при электролизе вещества пропорционально количеству пропущенного электричества и атомной массе с учетом валентности.
Регулируя температуру и силу тока в процессе электролиза, можно управлять как скоростью, так и направлением химической реакции. Ныне[3]
с помощью электролиза водных растворов получают в огромных количествах водород и кислород, хлор и его диоксид, гидроксид натрия, хлораты (соли хлорноватой кислоты НС103) и перхлораты (соли хлорной кислоты НСЮ4), а также металлы: медь, свинец, олово, кобальт, никель и др.
Плазмохимия исследует химические процессы в низкотемпературной плазме, разрабатывает основы плазмохимической технологии. Предпосылки ее формировались под названием «химия электрических разрядов», а ее становление относят к 1960;м гг., когда были выполнены основополагающие исследования в СССР, США и ФРГ. Профессор Л. С. Полак (1908—2002) — основатель научной школы плазмохимии в СССР.
Плазма — ионизированный газ.
Для получения плазмы необходимы внешние источники энергии, и часть этой энергии расходуется на осуществление химических процессов.
Различают слабоионизированную (низкотемпературную) и высокотемпературную плазму. В плазмохимии рассматриваются процессы при температурах от 1000 до 10 000°С. Частицы плазмы: молекулы, электроны, атомы, ионы, свободные радикалы находятся в возбужденном состоянии, существенно повышается интенсивность столкновения таких частиц, и они достаточно легко вступают в химические реакции. Конечные продукты выводятся из плазмы методом охлаждения, поэтому одним из основных этапов выступает закалка — процесс, связанный с резким охлаждением конечных продуктов, что позволяет сместить химическое равновесие в сторону стабилизации продуктов.
Для разрушения химических связей здесь зачастую энергии не требуется, поскольку многие из них в условиях высокой температуры уже разрушены. За счет этого существенно ускоряется протекание химических реакций (продолжительность 10-2—10~5 с). Это позволяет уменьшать габариты промышленной аппаратуры и оборудования. К примеру, для плазмохимического пиролиза метана был разработан плазменный реактор, который имеет производительность 25 000 т в год, размеры — 65 см в длину и диаметром 15 см[4].
При этом плазмохимические процессы являются легко управляемыми и хорошо оптимизируемыми. Многие плазмохимические процессы имеют место в промышленных масштабах: получение ацетилена и технического водорода из природного газа; ацетилена, этилена и водорода — из углеводородов нефти; производство синтез-газа для получения винилхлорида и др. Плазмохимические технологии позволяют получать чистые и высокочистые материалы (например, пленки кремния, используемые в полупроводниковой электронике), а также достигать необычной структуры или уникальных свойств соединений.
Радиационная химия (термин введен М. Бэртоном в 1945 г.) — относительно молодой раздел химии, изучающий химические процессы, вызы;
ваемые воздействием ионизирующих излучений на вещество. Ионизирующей способностью обладают электромагнитные излучения (рентгеновское излучение, у-излучение), а также потоки ускоренных частиц (электронов, протонов, нейтронов, тяжелых ионов; осколки деления тяжелых ядер и др.).
Этот раздел химии зародился в 1895—1896 гг., когда А. Беккерель обнаружил почернение фотографической пластинки в темноте под действием проникающего излучения солей урана. Работы, связанные с созданием и эксплуатацией ядерных реакторов, потребовали с середины XX в. изучения воздействия ионизирующих излучений на различные материалы. Химики установили закономерности радиационно-химических реакций, было положено начало радиационно-химической технологии: радиационные воздействия стали использоваться для полимеризации, модификации полимерных материалов, инициирования химических процессов синтеза и др.
Ионизирующие излучения могут существенно снижать температуру различных химических процессов без применения катализаторов, а также инициировать такие химические процессы, которые невозможны при использовании традиционных химических технологий. В процессе радиационно-химических реакций из кислорода образуется озон, из газообразных парафинов — водород, а также сложная смесь низкомолекулярных олефинов. Облучение многих полимеров приводит к повышению их термостойкости и твердости.
Радиационная химия находит применение и в медицине. К 1984 г. ученые смогли изготовить 1 г калифорния стоимостью в 1 млрд долл. Этот материал можно получить при бомбардировке ядер кюрия и плутония ускоренными альфа-частицами: 1 г калифорния получается при бомбардировке 10 кг плутония. Изотоп калифорния-252 активно испускает нейтроны, которые интенсивно поглощают опухоли. Исследователи из подмосковного Обнинска создали источники этого изотопа в виде стальных игл-цилиндров диаметром чуть более 1 мм с активными сердечниками из калифорния. Введенная в опухоль игла облучает ее изнутри1.
- [1] 2 Химическая энциклопедия. В 5 т. / гл. ред. Н. С. Зефиров. М.: Большая Российскаяэнциклопедия, 1995. Т. 4. С. 520.
- [2] В 1856 г. в США алюминий продавали по 12 долл, за фуит (454 г), а серебро —по 15 долл.
- [3] Паука. Величайшие теории. Вып. 22. Масса атомов. Дальтон. Атомная теория. С. 101.
- [4] 2 См.: Полак Л. С. Плазмохимия // Большая Советская энциклопедия. М.: Советскаяэнциклопедия, 1975. Т. 19. URL: http://enc-dic.com/enc_sovet/Plazmohimija-48 404/ (датаобращения: 25.02.2016).