Молекулярная сорбция.
Методы концентрирования и разделения радионуклидов

Возвращаясь к молекулярной сорбции солей щелочных элементов и аммония, отметим, что наиболее приемлемыми сорбентами для этой цели зарекомендовали себя смешанные ферроцианиды. В этих системах действительно была замечена одновременная сорбция катионов и анионов [3J. При этом катионы щелочных металлов занимали места в кристаллической решетке подобно тому, как это происходит при ионном обмене (кстати… Читать ещё >
Молекулярная сорбция. Методы концентрирования и разделения радионуклидов (реферат, курсовая, диплом, контрольная)
Теория молекулярной сорбции неэлектролитов из растворов — достаточно развитое учение, но на сильные электролиты (каковыми являются большинство солей щелочных металлов) данная теория не может быть безоговорочно распространена. Рассмотрим это явление сперва с самых общих позиций. В раствор электролита вносится сорбент, обладающий способностью молекулярно сорбировать электролиты, после чего концентрация этого электролита в растворе уменьшается. Наблюдается уменьшение концентрации не какого-либо иона, а именно электролита в целом. Появление сорбента в растворе не может повлиять на константы диссоциации электролита. Следовательно, тот факт, что катионы и анионы электролита ушли из раствора одновременно, кооперированно, можно в самом общем случае истолковать как сорбцию этих катионов и анионов по независимым химизмам, но эквивалентно по отношению друг к другу. Вопрос о том, находятся ли после этого акта катионы и анионы электролита в сорбенте в районе одних и тех же ФГ в ассоциированном состоянии, открыт. Закономерности пребывания электролита в водном растворе и в твердой фазе сорбента различны и не исключено, что изменение диэлектрической проницаемости, стехиометрических факторов и т. д. по сравнению с раствором может привести к возрастанию вероятности ассоциирования ионов электролита в твердой фазе.
Из этого рассуждения следует, что такой сорбент может быть: а) молекулярным сорбентом (если ассоциация ионов электролита происходит в районе одного и того же сорбционного центра) или б) амфолитом (если ионообменная сорбция происходит с участием разных ФГ, часть которых принадлежит катионитным функциональным группам, а другая, эквивалентная часть, — анионитным). В случае (б) сорбция должна сопровождаться ионообменными процессами, которые приводят к изменению в общем случае состава раствора. То есть, электролит М’А', являясь сорбатом, поглощается сорбентом, который функционирует как амфолит, и при этом в растворе появляется эквивалентное количество вещества М" А", где М" и А" —соответственно катион и анион, прежде находившиеся в составе твердой фазы. Предположение (б) является маловероятным, т. к. от функциональных групп амфолита по этой версии потребовалась бы «согласованность» в осуществлении ионного обмена с компонентами раствора М' и А', а это в общем случае невозможно сделать для произвольного сочетания ионов М', М", А' и А": в действительности каждый ион имеет собственное сродство к сорбционным центрам и поэтому вряд ли одновременная сорбция М' и А' на всем протяжении процесса будет строго эквивалентной. Но последнее требование — и есть признак молекулярной сорбции. Поэтому ее осуществление по схеме (б) следует признать событием маловероятным. Возвратившись к варианту (а), отметим, что в радиохимической литературе можно указать на некоторый прототип молекулярной сорбции электролита, который представляет собой самостоятельный процесс, не сводимый во всех своих чертах ни к одному из химизмов рассмотренных ранее. Это первичная потенциалопределяющая сорбция, которая, если сопоставлять ее с классификацией химизмов, ближе всего подходит к рубрике координационного эффекта. Хотя первичная потенциалопределяющая сорбция (ППС) изучена была в основном на гетерополярных кристаллах, а в круг данного обсуждения включены, как правило, неорганические полимеры, не следует слишком резко разграничивать эти классы твердых тел. Существуют взгляды, согласно которым такие типичные гетерополярные кристаллы, как труднорастворимыс сульфиды, можно отнести к неорганическим полимерам.
Известным примером ППС явлется адсорбция ионов Ra2+ на кристаллах сульфата свинца (II). Ионы радия «надстраивают» решетку твердой фазы, занимая те места, которые занимал бы РЬ2+, если бы кристалл продолжал расти. Радий в данном случае выступает как ион, изоморфный двухвалентному свинцу. В данном случае связь радия с осадком обеспечивается за счет межмолекулярных сил близкодействия, которые тождественны в данном случае силам координационной связи в RaS04 (а нужно сказать, что электронографические данные даже для сульфата цезия Cs2S04, хорошо растворимой соли, позволяют давать интерпретацию в рамках классической ковалентной структуры [14, с. 230]. Здесь употребляется термин «первичная адсорбция», хотя в общем случае имеет место сорбция. Но гетерополярные кристаллы, как правило, характеризуются хорошо выраженной поверхностью и слабой склонностью к адсорбции на внутренних стенках микроканалов (не в пример гранулам неорганических полимеров).
Сам по себе размер ППС обычно бывает небольшим, так как малая емкость поверхности не способствует адсорбции (чем совершеннее кристаллы сорбента, тем ниже емкость) и возникает кулоновское взаимное отталкивание ионов сорбата вследствие роста заряда поверхности. Именно поэтому адсорбция заряженных ионов не может характеризоваться большой емкостью. Заряд, возникший на поверхности вследствие адсорбции, создает определенный потенциал, в поле которого противоположно заряженные ионы будут испытывать кулоновское притяжение. Часть этих ионов будет находиться в плотном (молекулярном) контакте с первично адсорбированными, представляя собою картину, которая называется плотной (гельмгольцевой) частью двойного электрического слоя. Если теперь распространить представления о ППС с гетерополярных кристаллов на неорганические полимеры, где существует либо полианион, либо поликатион, то двойной электрический слой в таких объектах можно будет представлять в виде трехмерной композиции фиксированных (первично сорбированных) ионов одного знака и более подвижных (но располагающихся вблизи первых) ионов противоположного знака.
Это сочетание первично и вторично сорбированных ионов электролита в районе одной ФГ и можно представлять как молекулярную сорбцию. Упомянутое выше допущение, что часть вторично сорбированных ионов будет находиться в плотном гальмгольцевом слое (что соответствует ассоциированному комплексу), а часть — в более хаотичном, диффузном, не противоречит представлениям о сорбированных молекулах. Поскольку сорбированные молекулы имеют меньше степеней свободы, чем находящиеся в растворе, то их диссоциация.
(что является обязательным признаком любого электролита) протекает только в пределах двойного электрического слоя, в то время, как несорбированныс молекулы, диссоциируя, могут образовывать ионы в любой точке той части системы, которая занята раствором. В связи с этим можно даже предложить следующее образное высказывание: «Двойной электрический слой на гетсрополярных кристаллах можно истолковывать в ряде случаев как следствие диссоциации молекулярно-адсорбированного электролита».
Возвращаясь к молекулярной сорбции солей щелочных элементов и аммония, отметим, что наиболее приемлемыми сорбентами для этой цели зарекомендовали себя смешанные ферроцианиды. В этих системах действительно была замечена одновременная сорбция катионов и анионов [3J. При этом катионы щелочных металлов занимали места в кристаллической решетке подобно тому, как это происходит при ионном обмене (кстати сказать, П ПС бывает не только «сверхстехиометрическая», но и на дефектах решетки, как и в данном случае). Поскольку катионы входят в ячейки кристаллической решетки, то на них тем самым могут распространяться цеолитный и ситовой эффекты. Например, при молекулярной сорбции оксалатов щелочных металлов ферроцианидом никеля установлен такой же ряд сродства, что и при ионном обмене (С2042- обозначим как Ох2
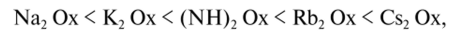
а оксалат тетраэтиламмония [N (C2H5)4]20x этим сорбентом не поглощается вследствие ситового эффекта. В явлении молекулярной сорбции есть место и координационному эффекту. В системах с ферроцианидными сорбентами он наблюдается по отношению к анионам сорбируемых солей. Чем менее специфичен этот эффект, тем менее вероятной становится молекулярная сорбция солей с ионами более легких щелочных металлов. В соответствии с этим может изменяться и коэффициент разделения солей этих металлов.