Алгоритм выполнения курсовой работы

Построить графическую зависимость стандартной ЭДС гальванического элемента от температуры. В случае если эта зависимость не линейна, провести касательную к точке на ней при температуре 298 К и найти угловой коэффициент касательной. Если зависимость стандартной ЭДС гальванического элемента линейна, то определить угловой коэффициент наклона самой линии. Записать уравнение Нернста для итоговой… Читать ещё >
Алгоритм выполнения курсовой работы (реферат, курсовая, диплом, контрольная)
Вариант А.
- 1. Изложить теоретический материал можно в произвольной форме, а можно просто сформировать текст, отвечая на следующие вопросы (нумерацию вопросов и сами вопросы писать не нужно):
- 1) Что такое гальванический элемент, чем он отличается от электролизера; из чего состоит гальванический элемент; что такое ЭДС гальванического элемента, чему она равна (через скачки потенциалов); что такое правильно разомкнутый гальванический элемент? Можно использовать иллюстрации.
- 2) Рассказать о классификации электродов, привести примеры (3−4 типа электродов), записать электродные реакции. В этом разделе нужно описывать те электроды, которые используются в курсовой работе. Так, например, при сочетании этого задания с заданием Е нужно будет рассказать о стеклянном электроде.
- 3) Рассказать, какие типы гальванических элементов бывают. Привести примеры.
- 2. Составить из данных в задании (прил. 1) электродов гальванический элемент без переноса. Для этого определить типы 34
электродов, выписать из справочника электродные реакции и значения стандартных электродных потенциалов при 298 К (прил. 2).
Сопоставить значения стандартных электродных потенциалов и составить правильно разомкнутый гипотетический гальванический элемент без переноса (записать его схему).
- 3. Записать реакции на электродах, итоговую токообразующую реакцию. Записать уравнение Нернста для токообразующей реакции.
- 4. Вычислить значение стандартной ЭДС полученного гальванического элемента через значения электродных потенциалов:
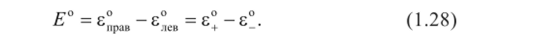
Вариант В.
- 1. Сформулировать цели, достигаемые при выполнении этого задания.
- 2. Построить графическую зависимость стандартной ЭДС гальванического элемента от температуры. В случае если эта зависимость не линейна, провести касательную к точке на ней при температуре 298 К и найти угловой коэффициент касательной. Если зависимость стандартной ЭДС гальванического элемента линейна, то определить угловой коэффициент наклона самой линии.
Это значение температурного коэффициента:

где А — довольно маленькое число (положительное или отрицательное).
В курсовой работе специально значения ЭДС даны в милливольтах, так как расчеты температурного коэффициента должны быть довольно точными. Размерность температурного коэффициента, получаемого из рисунка, построенного по данным таблицы, соответствует мВ/К. Однако следует помнить, что потом, при расчетах термодинамических величин, температурный коэффициент нужно будет перевести в В/К.
3. Для вывода формулы зависимости стандартной ЭДС гальванического элемента от температуры уравнение (1.29) нужно проинтегрировать.
После интегрирования получится формула вида.

где А — температурный коэффициент, В/К. Не забыть учесть знак.
По формуле (1.30) вычислить ЭДС при 298 К. Сравнить со значением, определенным по построенному рисунку и по формуле (1.28).
4. Произвести расчеты термодинамических величин, используя данные об ЭДС.
1)Для расчета стандартной мольной энергии Гиббса токообразующей реакции используется формула 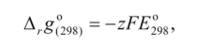
где z — число электронов, участвующих в реакции, протекающей в гальваническом элементе; F— число Фарадея, 96 485 Кл/моль.
В случае если значения стандартной ЭДС гальванического элемента при 298 К, полученные из справочных данных (1.28) и экспериментальных данных (1.30), разные, то для расчетов термодинамических величин нужно взять значение, которое получено в эксперименте, т. е. по уравнению (1.30).
2) Стандартную мольную энтропию реакции определяют по формуле.
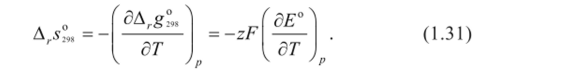
3) Стандартную мольную энтальпию токообразующей реакции находят следующим образом:
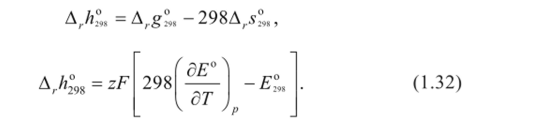
5. Для расчета стандартных мольных энергий Гиббса токообразующей реакции, стандартной мольной энтропии и энтальпии этой реакции по справочным данным составить таблицу, например, такую, как табл. 1.4.
Термодинамические данные дли расчета стандартных мольных энергии Гиббса, энтропии и энтальпии реакции
Таблица 1.4
Вещество. | Л/Сер(298),. кДж/моль. | <(298), Дж/(моль • К). | Д^:оСр(298),. кДж/моль. |
6. Произвести расчет изменения стандартных мольных экстенсивных свойств за счет протекания итоговой реакции в гальваническом элементе по справочным данным (прил. 3).

1) Стандартную мольную энтропию реакции находят по формуле где vk — стехиометрическое число вещества в данной реакции; Л;'<'(298) — стандартная мольная энтропия чистого вещества к при 298 К.
2) Для расчета стандартной мольной энтальпии и стандартной мольной энергии Гиббса итоговой реакции используют формулы.
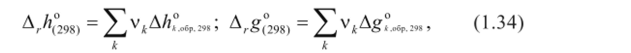
где А/г" Л,1Ч, — стандартная мольная энтальпия образования чистого вещества к из простых веществ при 298 К; Ag°ltfv m — стандартная мольная энергия Гиббса образования чистого вещества к из простых веществ при 298 К.
7. Сравнить значения величин, полученные в п. 4 и 6.
Вариант С.
- 1. Сформулировать цели этого вида задания. Изложить теоретический материал по возможности определения среднего ионного коэффициента активности электролита с использованием исследуемого гальванического элемента.
- 1) Привести схему гальванического элемента и уравнение итоговой реакции.
- 2) Записать уравнение Нернста для итоговой реакции и преобразовать его к виду, удобному для графического нахождения величины стандартной ЭДС гальванического элемента при температуре, указанной в задании. Пример преобразований для гальванических элементов, указанных в табл. 1, приведен далее в табл. 1.5.
Таблица 1.5
Примеры записи уравнений Нернста для графического определения Е° и средних ионных коэффициентов активности
Схема гальванического элемента. | Уравнение Нернста. |
Ag | Pt, Н21НС11 AgCl™, Ag. | n, 2RTt n0 2RT c Ел—In c = E—In у. F F |
Pt|Pb, PbCl™|HCl|H2, Pt. | " 2RT Л 2RT Л c E—In c = E ±In у. F F — |
Cu | Pb, РЬС12в|СиС12|Си. | 3 RT 3 RT E ln (4c) = ?°+ In у' 2 F 2 F *. |
Zn | ZnCl21 AgCl™, Ag Zn. | ^. 3RT, ,Л Л «» 3RT, c Ел--In (4c) = E—lny. 2 F 2 F |
Pb|Cd|CdS04|PbS07,Pb. | RT RT E +-lnc = ?°—In yl. F F |
Pb, PbSO™|CuS04|Cu|Pb. | RT RT E c = E°+ lnyl F F |
- 2. Определить величину стандартной ЭДС гальванического элемента при температуре, указанной в задании.
- 1) Сформировать вспомогательную таблицу для расчета величин, необходимых для дальнейшего графического определения стандартной ЭДС гальванического элемента при любой температуре. Таблица может иметь вид, например, как табл. 1.6.
Таблица 1.6
с, моль/л о'. | ||||||||||
F. | ||||||||||
А |
RT
А — это выражение типа ?-1—1псо (или другое в зависимо;
zF
сти от типа электродной реакции, см. табл. 1.5).
- 2) Построить графическую зависимость А от ЛJc^
- 3) Экстраполяцией кривой до оси ординат определяют величину стандартной ЭДС гальванического элемента при температуре опыта. Зависимость А от yfc^ может быть разной, и иногда она имеет максимум или минимум. Экстраполировать зависимость на нулевую ионную силу нужно только по участку кривой, приближающемуся к нулевой концентрации, а не усредняя данные по всему диапазону.
- 3. Определить средние ионные коэффициенты активности при концентрации раствора 0,01; 005 и 0,1 моль/л.
- 4. Провести расчет средних ионных коэффициентов активности при концентрации раствора 0,01; 005 и 0,1 моль/л по теории Дебая — Хюккеля (формулы 1.26, 1.27).
- 5. Сопоставить полученные значения со значениями, определенными экспериментально.
Вариант D.
- 1. Сформулировать цели этого вида задания. Изложить теоретический материал по возможности определения константы ионизации слабой кислоты (слабого основания) с использованием исследуемого гальванического элемента.
- 1) Привести схему гальванического элемента и уравнение итоговой реакции.
- 2) Записать уравнение Нернста для итоговой реакции и преобразовать его к виду, удобному для графического нахождения величины константы ионизации слабой кислоты.
- 2. Произвести необходимые для построения графика расчеты. Вычислить ионную силу растворов. Вычислить значения /(/) для каждой концентрации раствора слабой кислоты.
- 3. Изобразить зависимость /(/) от квадратного корня ионной силы раствора. Найти приближенное значение константы ионизации.
- 4. Сопоставить полученное значение со справочными данными. В случае большого расхождения провести повторное определение, учитывая концентрацию ионов гидроксония.
Вариант Е.
- 1. Сформулировать цели этого вида задания. Изложить теоретический материал по возможности определения константы ионизации слабой кислоты (слабого основания) с использованием исследуемого гальванического элемента, а также с использованием метода рН-метрии.
- 2. Перевести данные задания к курсовой к виду, удобному для графического определения константы ионизации методом рН-метрии.
- 3. Построить графическую зависимость и определить величины константы ионизации.
- 4. Сопоставить значения констант ионизации, полученные методом рН-метрии, со справочными (прил. 4).