Атомы, ионы и молекулы

Боровская модель является полуклассической моделью атома. Она была предложена в 1913 г. датским ученым, лауреатом Нобелевской премии по физике Нильсом Бором. В основе этой модели — планетарная модель атома. Однако с точки зрения классической электродинамики, электрон в модели Резерфорда, двигаясь вокруг ядра, должен был бы излучать энергию непрерывно и, потеряв се, упасть на ядро, что… Читать ещё >
Атомы, ионы и молекулы (реферат, курсовая, диплом, контрольная)
Свойства наноструктурированных материалов отличаются от свойств известных массивных материалов. Это объясняется прежде всего тем, что каждая физическая константа связана с характеристической длиной образца. Например, электросопротивление металлического образца объясняется рассеиванием электронов проводимости неколеблющихся атомов в примесях. В качестве характерного параметра следует брать длину свободного пробега электронов или характеристическую длину. При приближении характерного размера образца к характеристической длине значения электросопротивления меняются на порядок.
Электронная структура сильно зависит от числа измерений, по которым образец имеет нанометровые размеры.
В природе существует 91 атом, и каждый из них имеет различный заряд ядра, состоящего из протонов и нейтронов. Положительный заряд равен числу протонов, а атом в целом электронейтрален. Поэтому соответствующее число электронов находится на орбитах атома. Самый легкий атом — атом водорода, содержит один протон и один электрон. Затем следуют гелий (+2), литий (+3) и т. д.
Самый тяжелый из существующих в природе атомов — уран. Он имеет заряд (+92). Соответствующее число электронов, 92, находится на орбитах. Почему 92 электрона, а типов атомов 91? Причина в том, что элемент с номером 43, технеций, в природе еще не найден.
Историческая справка Основную единицу наномира, называемую ангстремом (А), ввел шведский ученый Ангстрем, в честь которого она названа. Имя этого физика и астронома — Андерс Йонас. Его сын, Кнут Юхан, был известным геофизиком. Внук Андерсадеда, тоже Андерс, стал геофизиком и исследовал солнечную активность.
Если число электронов не равно числу протонов, то атом имеет ненулевой заряд и называется ионом. Различают положительно заряженные ионы {анионы) и отрицательно заряженные {катионы). Все атомы имеют размер порядка 1 А. Наибольший диаметр у урана, он составляет порядка 2,2 А. Размер атомов различается не более чем в три раза (рис. 2.1).
Атомы связываются в стационарную структуру и формируют молекулы. Известно более миллиона типов молекул, а сотни молекул синтезируются и открываются каждый год. Атомы связываются в молекулы за счет химических связей, которые порождены взаимодействием электронов и атомов или ионов. Разрыв или формирование связей является химической реакцией. Эти связи являются ключом к процессам нанотехнологий. В наиомире молекулы могут выполнять функцию устройств, а связи могут быть компо;
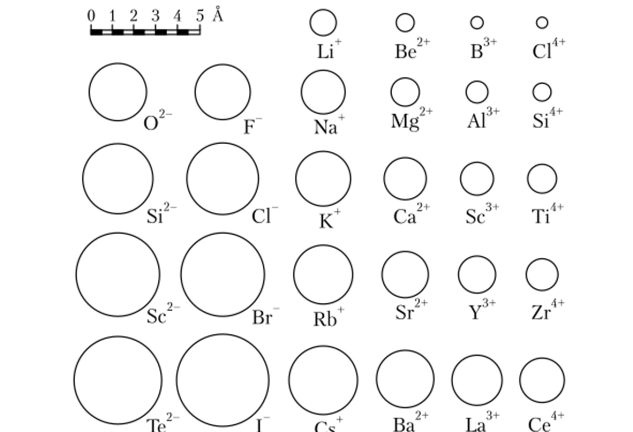
Рис. 2.1. Радиусы различных ионов (по Л. Полингу) нентами этих устройств. Большие молекулы с периодической структурой, называемые полимерами, являются весьма распространенными материалами в нанотехнологиях.
Историческая справка Эволюция модели атома Атом Томсона или «иудинговая модель атома».
Англичанин Джозеф Джон Томсон в 1897 г. открыл электрон и получил Нобелевскую премию, но физике. В 1904 г. он предложил модель атома. Согласно модели Томсона в облаке положительного заряда, равного размеру атома, содержатся маленькие, отрицательно заряженные «корпускулы», суммарный электрический заряд которых равен заряду положительно заряженного облака. Это положение обеспечивает электронейтральность атомов. Электроны в этой модели распределены внутри положительно заряженного облака с одинаковой по объему плотностью заряда по аналогии с изюминками в тесте пудинга. В дальнейшем модель атома Томсона была опровергнута экспериментами. Планетарная модель Резерфорда. В 1911 г. Эрнст Резерфорд, сын колесного мастера из Новой Зеландии, впоследствии директор Кавендишской лаборатории, нобелевский лауреат по химии, предложил модель атома. В соответствии с планетарной моделью атома вокруг положительно заряженного ядра вращаются отрицательно заряженные электроны. Вся масса атома практически сосредоточена в ядре, модель атома напоминает модель Солнечной системы. Однако эта модель несовместима с законами классической механики и имеет только квантомсханичсскос описание.
Боровская модель является полуклассической моделью атома. Она была предложена в 1913 г. датским ученым, лауреатом Нобелевской премии по физике Нильсом Бором. В основе этой модели — планетарная модель атома. Однако с точки зрения классической электродинамики, электрон в модели Резерфорда, двигаясь вокруг ядра, должен был бы излучать энергию непрерывно и, потеряв се, упасть на ядро, что недопустимо. Бор ввел постулат, в соответствии с которым электроны в атоме могут двигаться только по определенным (стационарным) орбитам, находясь на которых, они не излучают. Процессы излучения и поглощения происходят в момент перехода с одной орбиты на другую. Причем стационарными являются лишь те орбиты, при движении по которым момент количества движения электрона равен целому числу постоянных Планка.
Атом Эрвина Шредингера — австрийского физика, лауреата Нобелевской премии по физике. Он создал новую механику для движения внутри атомов и молекул. По Шредингеру, электрон в атоме не существует как частица. Он расплывается в облако. Если электронов несколько, то формируется система облаков, а их плотности и расстояние до центра атома определяются законами квантовой механики. Границы атома рсзсрфордовские. При переходе электрона с одного облака на соседнее (нижнее) испускается квант света hv.