Соединения ртути.
Химия элементов

Hg (OH)2 не получен. Hg (N03)2 (или Hg (N03)2−½Н20) хорошо растворим в воде. В разбавленных растворах в отсутствие кислоты з га соль гидролизуется с образованием белого осадка — основного нитрата ртути (П) Hg (N03)0H (или HgO • Hg (N03)2): Хлорид ртути (Н) IIgCl2 — белое кристаллическое вещество, растворимое в воде (при 20 °C 6,6 г в 100 г II., О). Его получают растворением ртути в горячей… Читать ещё >
Соединения ртути. Химия элементов (реферат, курсовая, диплом, контрольная)
Катион [Hg2]2+ имеет своеобразное строение: каждый такой ион состоит из двух ионов Hg2+, ковалентно связанных друг с другом за счет имеющихся у них двух электронов | Hg: Hg|2+. Катион | Hg2|2+ образуется при восстановлении солей Hg2' в водных растворах. В зависимости от природы аниона расстояния Hg—Hg меняются. Минимальная длина связи характерна для тех анионов, которые обладают наименьшей способностью к ковалентному связыванию, например для N03.
Для правильного понимания химии [Hg2]2+ важное значение имеют величины потенциалов в следующих процессах:
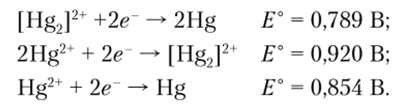
Для реакции диспропорционирования.
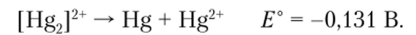
Эти значения показывают, что окисление ртути до Hg+ можно осуществлять такими окислителями, потенциалы которых лежат в пределах от -0,79 до -0,85 В. Поскольку такие окислители подобрать сложно, то обычно используют 50%-ный избыток ртути, так как металлическая ртуть восстанавливает Hg2+ до [Hg2]2+. Следует учесть, что любые реагенты, которые понижают активность Hg2+ в большей степени, чем [Hg2]2+, будут способствовать реакции диспропорционирования. Так, добавление ионов ОН к раствору I Hg2p приводит к реакции.
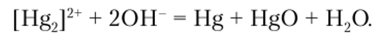
Для ртути (1) известны оксид Hg20, галогениды Hg2Hal2, нитрат Hg2(N03)2 и некоторые другие, большинство из которых бесцветны и труднорастворимы в воде.
Hg2(N03)2 образуется при восстановлении Hg (N03)2 металлической ртутью: 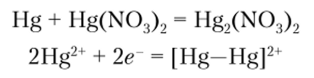
Hg2Cl2 (каломель) в воде нерастворим. Молекула имеет линейную ковалентную структуру:
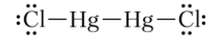
По формированию Hg2Cl2 и изменению его цвета от белого до черного при добавлении раствора NH3 судят о наличии [Hg2]2+ в анализируемом растворе (качественная реакция на [Hg2]2+). В этой реакции диспропорционирования образуются мельчайшие частицы ртути (черного цвета) и амидохлорида IIg2+ (белого цвета):
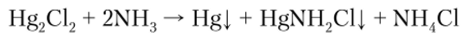
Соединения |Hg2]2t проявляют и окислительные, и восстановительные свойства, что определяется характером партнера по реакции.
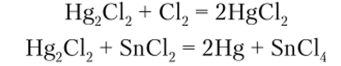
Соединения Hg (II) обладают ярко выраженной тенденцией образовывать ковалентные связи. Например, ковалентный HgS, представляющий собой кристаллическое вещество, гораздо хуже растворим, чем ZnS или CdS.
Оксид IlgO в виде желтого осадка выделяется из растворов солей I Ig2+ при действии на них щелочей:
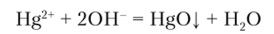
Hg (OH)2 не получен. Hg (N03)2 (или Hg (N03)2-½Н20) хорошо растворим в воде. В разбавленных растворах в отсутствие кислоты з га соль гидролизуется с образованием белого осадка — основного нитрата ртути (П) Hg (N03)0H (или HgO • Hg (N03)2):
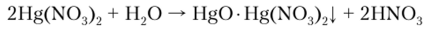
Хлорид ртути (Н) IIgCl2 — белое кристаллическое вещество, растворимое в воде (при 20 °C 6,6 г в 100 г II., О). Его получают растворением ртути в горячей концентрированной H., SO^ с последующим нагреванием сухого HgS04 с NaCl:
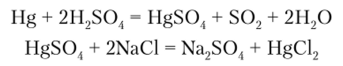
HgCl2 очень слабо гидролизуется, что связано со строением молекулы, имеющей линейную ковалентную структуру:
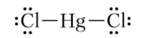
На свету одновременно с реакцией гидролиза протекает и реакция фотолиза с образованием каломели:
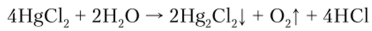
В разбавленных растворах HgCl2 реагирует с NH3 с образованием нерастворимого амидохлорида (реакция аммонолиза):
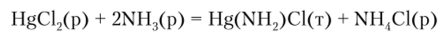
При большом избытке МН3 и в присутствии NH^Cl образуются аммиакаты ртути (П) — [Hg (NH3)4]2‘(N03)2. В очень концентрированных растворах NH4C1 происходит образование нерастворимого осадка [Hg (NH3)2Cl2]:
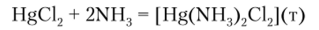
Катион Hg (II) образует комплексные анионы в присутствии галогениданионов и CN: |HgCl4]2 и |Hg (CN) J2. В аналитической химии для обнаружения катиона Hg2+ широко пользуются образованием комплексной соли К2[ I IglJ, получение которой сводится к следующим реакциям:
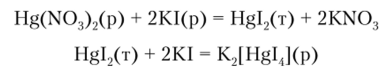
IIgI2 осаждается в виде оранжево-красного осадка, который в избытке KI растворяется, образуя бесцветный раствор комплексной соли тетраиодмеркурата (П) калия, известной под названием реактива Несслера.
Хлорид ртути (И) (ртути дихлорид) HgCl2 (сулема) — очень ядовитое соединение. Обладает дезинфицирующим действием, избирательно действуя на микроорганизмы. Применяется наружно в больших разведениях (1: 1000.
и 2: 1000). Для отличия от растворов других веществ растворы сулемы обычно окрашивают в красный или синий цвет.
Хлорид ртути (1) (монохлорид ртути) Hg2Cl2 (каломель) — ядовитое соединение. Получают нагреванием смеси металлической ртути с сулемой:
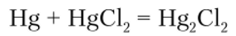
Применяется преимущественно наружно в мазях и присыпках.
Ртуть при обычных условиях — жидкий металл, который способен растворять другие металлы. При этом образуются твердые сплавы — амальгамы. В стоматологии для пломбирования зубов издавна применяли амальгамы серебра и кадмия. Они химически инертны, легко размягчаются при нагревании и поэтому легко формуются.
Жидкая ртуть используется в ряде приборов, применяемых в медицине. Например, для измерения артериального давления, в медицинских термометрах. В настоящее время соединения ртути в медицинской практике не применяются из-за их высокой токсичности.