Квантовые числа.
Энергии и конфигурации электронных орбиталей атома

Как очевидно из уравнения (9.7), энергия электрона в атоме обратно пропорциональна квадрату главного квантового числа, поэтому с возрастанием п энергетические уровни сближаются, и на рис. 9.3 удалось показать только шесть энергетических уровней: линии, изображающие более высокие уровни, сливаются. При п = °° энергия электрона становится равной нулю, что соответствует бесконечно большому… Читать ещё >
Квантовые числа. Энергии и конфигурации электронных орбиталей атома (реферат, курсовая, диплом, контрольная)
Главное квантовое число п. В одноэлектронном атоме, т. е. в системе, состоящей из двух заряженных частиц — ядра с зарядом +z и одного электрона, главное квантовое число однозначно определяет полную энергию электрона:

где те — масса электрона; е — заряд электрона; h — постоянная Планка.
Главное квантовое число п может принимать любые целочисленные значения от 1 до °°.
Из уравнения (9.7) очевидно, что энергия электрона в атоме принимает не любые, а только строго определенные главным квантовым числом (квантованные) значения. Эти значения энергии называют энергетическими уровнями.
Графически связь между расстояниями гп от ядра, на которых вероятность нахождения электрона максимальна,.
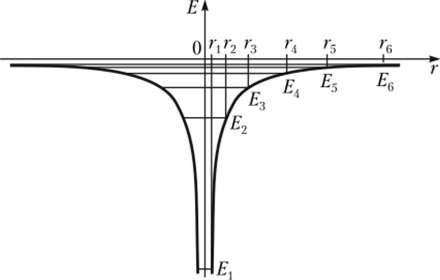
Рис. 93. Потенциальная «яма» одноэлектронного атома.
и соответствующими энергиями Еп изображается энергетической или потенциальной «ямой» одноэлектронного атома. На рис. 9.3 эта «яма» изображена с горизонталями, означающими энергетические уровни Еп, отсчитываемые вниз от уровня Еоо = 0, который отвечает электрону, удалившемуся от ядра в бесконечность.
Поскольку величины Еп имеют знак «минус» [см. уравнение (9.7) |, энергетический уровень Е дает минимальное значение полной энергии электрона. Ниже этого значения энергия электрона быть не может. Энергетический уровень Е называется основным или невозбужденным.
Остальные уровни являются возбужденными, так как электрон поднимается на них с основного уровня в результате возбуждения атома. Такое возбуждение достигается, например, при поглощении кванта света с энергией /zv:
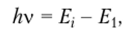
где Е — энергия электрона на любом i-м уровне.
Обратный переход происходит самопроизвольно с испусканием кванта света той же энергии.
Как очевидно из уравнения (9.7), энергия электрона в атоме обратно пропорциональна квадрату главного квантового числа, поэтому с возрастанием п энергетические уровни сближаются, и на рис. 9.3 удалось показать только шесть энергетических уровней: линии, изображающие более высокие уровни, сливаются. При п = °° энергия электрона становится равной нулю, что соответствует бесконечно большому расстоянию между ядром и электроном.
Орбитальное квантовое число /. В многоэлектронных атомах происходит расщепление энергетических уровней на.
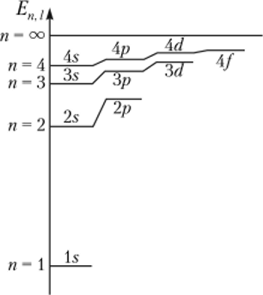
Рис. 9.4. Расщепление энергетических уровней многоэлектронного атома на подуровни
подуровни (рис. 9.4), которое можно объяснить тем, что энергия каждого электрона определяется не только взаимодействием электрона с ядром, но и взаимодействием с другими электронами. В таких атомах полная энергия электрона Enj задается не только главным квантовым числом /?, но и орбитальным квантовым числом I.
Возможные значения / задаются для каждого уровня главным квантовым числом.
Орбитальное квантовое число может принимать все неот рицательные целочисленные значения от 0 доп — 1, где п — главное квантовое число.
Это значит, что число возможных значений / при данном п также равно п. Например, если п = 2, то орбитальное квантовое число / может принимать значения 0 и 1, т. е. два значения.
Числовые значения I имеют буквенные обозначения, которые удобнее в употреблении:
Обозначение. | Р | d |
Соответственно говорят о 5-, р-у d-f /-состояниях электрона, s-, p-, d-,/-орбиталях, s-, p-, d-f /-волновых функциях j и s-y p-у d-y /-подуровнях с энергиями Enj.
Подуровни принято обозначать символами, состоящими из цифры и буквы: цифра — это помер энергетического уровня (главное квантовое число), а буква — обозначение орбитального квантового числа. На первом энергетическом уровне с п = 1 имеется только один подуровень с / = 0. Это ls-подуровень. На втором уровне имеются два подуровня: 2s и 2р, что соответствует п = 2, / = 0 и / = 1. На третьем и четвертом уровнях имеются соответственно три (3s, 3р, 3d) и четыре (4s, 4р, Ad, 4/) подуровня.
Расщепление уровня на подуровни происходит так, что ниже всех лежат s-иодуровни, а за ними, если они есть на данном уровне, идут последовательно р-, d-, /-подуровни (см. рис. 9.4).
Различным подуровням соответствуют различные-функции и различные описываемые ими конфигурации электронных облаков.
Существенно при этом, что в основных своих чертах форма электронных облаков не зависит от главного квантового числа, а определяется значением /. Иными словами, Is, 2s, 3s и т. д., т. е. все s-облака, все.-функции подобны друг другу и различаются размерами, которые увеличиваются с ростом п (рис. 9.5). Если орбитальное квантовое число / = 0, то независимо от главного квантового числа электронные облака s-электроиов имеют сферическую форму.
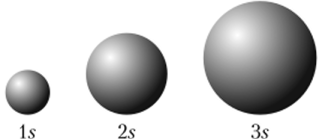
Рис. 9.5. Размеры орбиталей определяются главным квантовым числом п.
Орбитальное квантовое число I определяет пространственную форму электронного облака.
Подобно синусоидальной волне, амплитуда которой обладает знаком, электронное облако имеет области с различными знаками %,5. Это проявление волновых свойств электрона в атоме. Волновая функция *Р15 сохраняет знак при любых г (рис. 9.6). Волновые функции Ф25 и s имеют на разных удалениях от ядра различные знаки.
Характер изменения *F2$ и означает существование у электронного облака 2s двух сферических областей, «слоев», с высокой электронной плотностью, а у электронного облака 3s — трех таких областей повышенной плотности.
Иную форму имеют облака /7-электронов, для которых орбитальное квантовое число 1=1. Для этих облаков при любом главном квантовом числе п характерна конфигурация гантели (рис. 9.7, а). Если вместо размытого облака условно изоб;
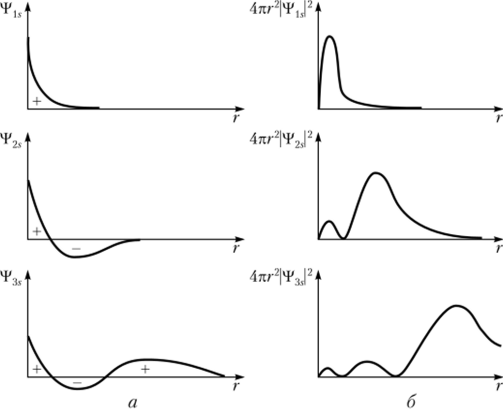
Рис. 9.6. Сравнение Is-, 2sи Зв-волновых функций (а) и соответствующих им вероятностей нахождения электрона (б) на расстоянии г от ядра.
ражать поверхности, ограничивающие пространство, внутри которого вероятность обнаружения электрона максимальна (рис. 9.7, б), то символически р-облако можно представить в виде объемной «восьмерки», в центре которой находится ядро (рис. 9.7, в).
Еще сложнее конфигурация «/-облаков (/ = 2) (рис. 9.8). Эти облака имеют форму четырехлепестковых розеток, т. е. двух объемных восьмерок, расположенных по отношению друг.
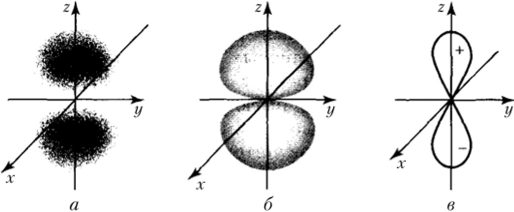
Рис. 9.7. Различные способы изображения р-электронного облака:
а — вид «снаружи»; 6 — изображение в виде поверхностей, внутри которых вероятность обнаружения электрона составляет 90%; в — условное изображение.
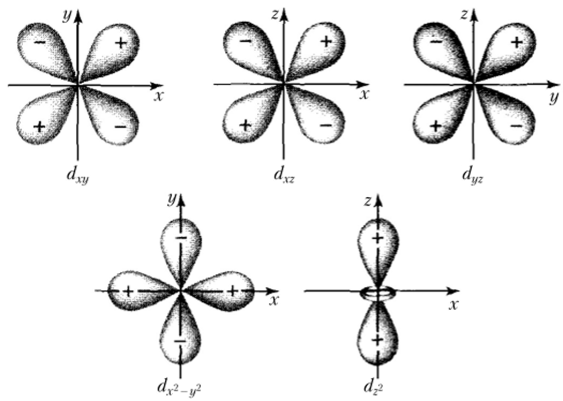
Рис. 9.8. Пять различных возможностей расположения в пространстве J-электронных облаков.
к другу под углом в 90°. Ядро находится в точке «пересечения» этих восьмерок. Другая возможная форма ^/-облаков — объемная восьмерка с кольцом, окружающим перемычку.
Магнитное квантовое число т. Это число определяет квантовый характер взаимодействия электронов атома с внешним магнитным полем.
Магнитное квантовое число т может принимать целочисленные отрицательные и положительные значения отI до +/, включая нуль, где I — орбитальное квантовое число.
Это означает, что каждому значению / соответствует свой набор магнитных квантовых чисел т, состоящий из 2/ + 1 таких чисел. Иными словами, на подуровне /, независимо от главного квантового числа п, всегда имеется 2/ + 1 атомных орбиталей.
Магнитное квантовое число определяет число орбиталей на каждом подуровне и их взаимное расположение в прост ранстве.
Для s-подуровня I = 0 и потому т имеет единственное значение: т = 0. Таким образом, на 5-подуровне всегда существует единственная 5-орбиталь.
Для р-электронов или p-подуровня / = 1 и т приобретает три значения: -1, 0, +1, т. е. /^-подуровень всегда имеет три р-орбитали.
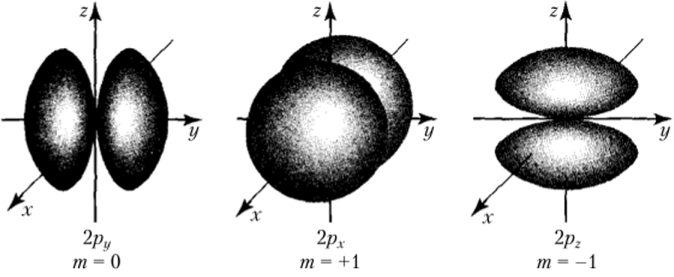
Рис. 9.9. Три возможности расположения p-электронных облаков в пространстве в соответствии с тремя различными значениями магнитного квантовового числа
Аналогично d-подуровень с / = 2 имеет т = -2, -1, 0, +1, +2 и, следовательно, пять орбиталей, а /-подуровень с / = 3 имеет т = -3, -2, -1, 0, +1, +2, +3, т. е. семь орбиталей.
Так как на /?-, d- и /-подуровнях располагаются три, пять и семь орбиталей соответственно, возникает вопрос о взаимном расположении их облаков в пространстве.
В случае р-подуровней орбитали — объемные восьмерки, число которых равно трем, располагаются на трех осях декартовых координат (рис. 9.9).
d-орбитали не одинаковы по форме и взаимному расположению. Три d-орбитали располагают лепестки своих розеток по диагоналям декартовой системы координат (между осями). Это орбитали dxy, dxz и dyz (см. рис. 9.8). Орбиталь dx2_y2 также имеет форму четырехлепестковой розетки, но с лепестками, лежащими на осях х и у. Орбиталь dz2 — объемная восьмерка с кольцом, лежащая на оси г.
Подуровень/имеет еще более сложное взаимное расположение своих орбиталей.
Спиновое квантовое число s. Спин — это собственный момент количества движения электрона. Хотя спин — чисто квантовое явление и аналогий в классической теории не имеет, можно для наглядности считать, что как любое физическое тело электрон может вращаться и иметь момент количества движения. В атоме этот момент количества движения квантуется и определяется спиновым квантовым числом s.
Спиновое квантовое число для электрона в атоме может принимать только два числовых значения: -½ и +½. Оно определяет число электронов, которое может находиться па орбитали.
В соответствии с принципом Паули (см. параграф 9.4) на одной орбитали может находиться не более двух электронов.