Квантовые постулаты Бора.
Атом водорода по Бору

Обозначения линий соответствуют переходам, показанным на рис.14; эти линии составляют часть серии Бальмера. Поглощение света — процесс обратный излучению атома. Атом поглощает свет, переходит из низших состояний в высшие. При этом он поглощает фотон той же частоты, которые излучает, переходя из высших энергетических состояний в низшие. Успехи теории атома водорода были получены ценой отказа… Читать ещё >
Квантовые постулаты Бора. Атом водорода по Бору (реферат, курсовая, диплом, контрольная)
Выход из затруднительного положения был найден Н. Бором в 1913 г на пути дальнейшего развития квантовых представлений о процессах в природе. Эйнштейн оценивал проделанную Бором работу как высшую музыкальную область мысли, всегда его поражавшую. Основываясь на разрозненных опытных фактах, Бор с помощью гениальной интуиции правильно предугадал сущность дела. Последовательной теории атома Бор, однако, не дал. Он в виде постулатов сформулировал положения новой теории. Причем и законы классической физики не отвергались им безоговорочно. Новые постулаты скорее налагали лишь некоторые ограничения на допускаемые классической физикой движения. Успех теории Бора был, тем не менее, поразительным, и всем ученым стало ясно, что Бор нашел правильный путь развития теории. Этот путь привел в последствии к созданию стройной теории движения микрочастиц — квантовой механики.
Н. Бор (1885−1962) работал в 1912;1913 у Резерфорда, когда тот проводил опыты по рассеянию, и вернулся в 1913 в Копенгаген с множеством новых идей. Требовал своего объяснения ряд явлений, помимо только что открытых в «ядерных» экспериментах по рассеянию. Теперь, когда была отвергнута томсоновская модель атома, узкие, дискретные спектральные линии в излучении разрядных трубок и эмпирические закономерности в их частотах казались еще менее понятными. Был и другой атомный эффект, открытый в 1887 Г. Герцем (1857−1894), а именно фотоэффект. Суть его в том, что свет, падающий на свежеочищенную поверхность металла, выбивает из нее электроны, если частота света достаточно высока. Для каждого металла имеется своя пороговая частота. Опыты показали, что тормозящее электростатическое поле, уменьшающее до нуля ток фотоэлектронов, не зависит от интенсивности света, но зависит от его длины волны. Электромагнитная теория, согласно которой свет представляет собой электромагнитные волны, оказалась не в состоянии объяснить это, поскольку по этой теории для испускания электрона с любой скоростью атому нужно только достаточно долго поглощать энергию.
В 1905 А. Эйнштейн (1879−1955) предложил объяснение фотоэффекта, которое полностью согласовалось с экспериментальными данными, но требовало коренного пересмотра существовавшей концепции света как волнового процесса. Эйнштейн предположил, что свет переносит энергию порциями, которые называются фотонами или квантами света, причем их энергия дается выражением E = hn, где n — частота света, а h — «постоянная Планка», равная 6,626Ч10−34 ДжЧс. Попадая на поверхность металла, фотон передает всю свою энергию электрону. Поскольку электрон связан с поверхностью электростатическими силами, ему для вылета необходима энергия W («работа выхода»), а остальная часть полученной электроном энергии превращается в его кинетическую энергию, т. е. h? = W + ½mv2. Гипотеза Эйнштейна объясняла, почему кинетическая энергия фотоэлектронов зависит от частоты света, а число испускаемых электронов — от его интенсивности. Как часто происходит с научными открытиями, оказалось, что гипотеза «квантов» Эйнштейна имеет в своей основе более раннюю теорию. М. Планк (1858−1947) первым привлек идею квантования для объяснения наблюдаемого спектрального состава излучения нагретых тел. Ему удалось объяснить спектр, предположив, что гармонические осцилляторы поглощают и излучают лишь дискретные порции энергии h?. Бор блестяще применил квантовую гипотезу к описанию орбит электронов в атомах и их излучения. Он отбросил идею о том, что электроны ведут себя подобно осцилляторам, а вместо этого представил динамику атома в виде движения электронов по орбитам вокруг ядра, наподобие движения планет по орбитам вокруг Солнца. Бор сформулировал постулаты, в которые модель атома Резерфорда согласовывалась с экспериментальными фактами (стабильность атома, дискретный характер излучаемой и поглощаемой им энергии).
Первый постулат стационарных орбит.
I. Атомная система может находиться только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия Еn, в стационарном состоянии атом не излучает.
Постулат требует пояснений: энергия атома квантуется, то есть принимает ряд дискретных значений. Наименьшей энергий атом обладает тогда, когда электрон находиться на ближайшей к ядру орбите. Чем больше радиус орбиты, тем большая энергия соответствует стационарному состоянию. Излучение возникает только при переходе электрона с одной квантованной орбиты на другую. Этот постулат находиться в явном противоречии с классической физикой, согласно которой энергия движущихся электронов может быть любой. Противоречит он и электродинамики Максвелла, так как допускает возможность ускоренного движения электронов без излучения электромагнитных волн.
Второй постулат Бора.
II. При переходе атома из одного стационарного состояния в другое излучается или поглощается фотон с энергией hn, равной разности энергии стационарных состояний. Частота этого излучения определяется изменением полной энергии, т. е. разностью энергий атома в начальном и конечном состояниях:
hn = E2 — E1., (2.10).
где 1и 2 номер стационарных состояний. При Е 2 >E1 происходит излучение фотона, а при E2 < E1 — происходит его поглощение. Эти условия квантования энергии приводят к дискретным орбитам электронов. Частота колебаний, соответствующая испускаемому (или поглощаемому) кванту излучения, определяется формулой.
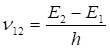
(2.11).
Постулат обосновывает квантовый характер излучения, который был предложен Планком, и доработан Эйнштейном.
Здесь также существует противоречие электродинамике Максвелла, так как согласно этому постулату излученного света свидетельствует не об особенностях движения электрона, а лишь об изменении энергии атома. Третий постулат
При изложении теории Бора возникает вопрос, нужно ли знакомить школьников с правилами квантования орбит, третьим постулатом Бора. Так как данный материал предлагается для профильных классов, то школьники уже знакомы с понятием момент импульса. Но для общеобразовательных классов понятие момента импульса не знакомо, поэтому его лучше осветить следующим образом: При движении электрона по круговой орбите модуль его импульса и радиус орбиты остается неизменным. Следовательно, постоянной будет и величина. В классической механике величина называется моментом импульса — это векторная физическая величина. При вращении по орбите радиуса r частица массой m, движется со скоростью V, вектор момента импульса связан с направлением вращения правилом буравчика.
Далее Бор обратил внимание на то, что размерность момент импульса совпадает с размерностью постоянной Планка.
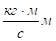
().
Будучи уверенным, в том, что постоянная Планка h должна играть важную роль в теории атома, он постулировал еще и правило квантования орбит: в стационарном состоянии атома электрон, двигаясь по круговой орбите, имеет дискретное, квантовое значение момента импульса:
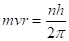
(2.12).
Это и есть правило квантования, третий постулат.
В стационарных состоянии электрон может двигаться только по такой (разрешенной) орбите, радиус которой удовлетворяет условию.
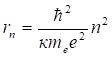
(2.13).
По предложению Бора, спектр энергий электронов в атоме является дискретным, т. е. электроны характеризуются не непрерывными значениями своих координат, импульсов и энергий, как это происходит в классической физике, а могут находиться только в строго определенных состояниях с фиксированными значениями этих величин. Это предположение возникло как естественное распространение квантовых представлений о природе электромагнитного излучения на поведение электронов в атоме. Далее Бор применил свои постулаты для объяснения свойств атома водорода. Основная задача состояла в нахождении частот электромагнитных волн, излучаемых водородом.
Модель эта была разработана на основе следующих положений. 1. Электрон может вращаться вокруг ядра не по всевозможным орбитам, а лишь по некоторым определенным. На таких «дозволенных» орбитах он вращается, не излучая энергии. 2. Ближайшая к ядру орбита соответствует наиболее устойчивому («нормальному») состоянию атома (основное состояние атомасостояние с минимальной энергией). При сообщении атому энергии извне электрон может перейти на одну из более удаленных орбит, причем запас его энергии будет тем больше, чем дальше от ядра орбита, на которую он переходит, такой электрон находится на более высоком энергетическом уровне. Атом, содержащий электрон на одном из высоких энергетических уровней, в отличие от нормального, называют «возбужденным». 3. Поглощение и излучение атомом энергии имеет место только при скачке электрона с одной орбиты на другую. При этом разность энергий начального () и конечного () состояний воспринимается или отдается в виде кванта лучистой энергии (фотона), отвечающего излучению с частотой колебаний, определяемой возможным соотношением (2.10).
Изложенные представления позволили вычислить радиусы различных «дозволенных» квантовыми условиями орбит электрона в атоме водорода. Условие квантования дает связь между скоростью электрона и радиусом разрешенной орбиты. Второй закон Ньютона и закон Кулона тоже связывают радиус и скорость электрона. Если скомбинировать эти два условияклассическое и квантовое, — то мы получим строго определенные радиусы разрешенных орбит.
Из классического условия мы имеем.
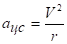
(2.14).
из электродинамики кулоновская сила равна.
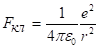
(2.15).
Так как, приравняем силы, мы получим.
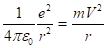
(2.16).
Сократим радиус, получим.
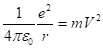
(2.17).
а из квантового.
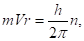
(2.18).
Разделим (2.17) на, получим.
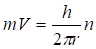
(2.19).
Возведем теперь обе его части в квадрат:
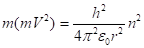
(2.20).
а затем разделим на :
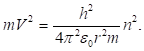
(2.21).
Таким образом, мы получили два выражения для .Так как две величины, равные одной и той же величине, равны между собой, имеем.
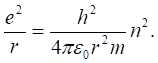
(2.22).
Умножая это выражение на радиус в квадрате, и деля на квадрат заряда электрона, получаем радиус разрешенных орбит.
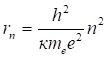
(2.23).
Наименьший из возможных радиусов, называемый боровским радиусом, соответствует значение. Его величину можно вычислить, подставив в формулу значение постоянной Планка, значение массы электрона и его заряда.
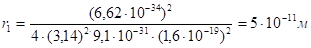
(2.24).
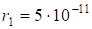
м Оказалось, что радиусы относятся друг к другу как 12:22:32:42:…:n2. Величина n была названа главным квантовым числом. Как видно из приведенного выше, n может принимать различные значения, соответствующие натуральному ряду целых чисел.
Радиусы боровских орбит меняются дискретно с изменением числа n.
Постоянная Планка, масса и заряд электрона определяют возможные значения электронных орбит. Размеры атома определяются квантовыми законами. Классическая теория не может объяснить, почему атом имеет размеры порядка 10−10 м.
Энергия электрона в атоме складывается из его кинетической энергии и потенциальной кулоновской энергии взаимодействия с ядром.
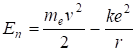
(2.25).
Нуль потенциальной энергии электрона выбран на бесконечном расстоянии от ядра. На всех близких расстояниях энергия меньше нуляотрицательна. Знак минус соответствует энергии притяжения отрицательного и положительного зарядов. Энергия электрона в атоме определяется следующим образом;
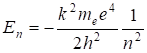
(2.26).
Энергия в атоме принимает не любые значения, дискретные, то есть квантуется.
Энергетический уровень — энергия которой обладает атомный электрон в определенном стационарном состоянии. Атом водорода имеет определенный спектр энергий. Состояние атома с n=1 называют основным состоянием. Основное состояние атома (молекулы) — состояние с минимальной энергией. Энергия основного состояния электрона в атоме водорода.
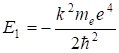
=-13,6 эВ В основном состоянии электрон находится ближе к ядру и его энергия связи с ядром максимальна по модулю.
Возбужденное состояние атома — состояние с n>1 по модулю Чем больше главное квантовое число, тем дальше от ядра находится электрон, тем выше его энергетический уровень. Энергетические уровни принято изображать горизонтальными линиями, перпендикулярными оси энергий (рис. 9.а).

Рис. 9.Энергетический спектр атома водорода.
- а) свободные и связанные состояния.
- б) переходы электрона при поглощении света
При n электрон удаляется от ядра на бесконечно большое расстояние, а его энергия связи стремится к нулю. Это означает, что при Е=0 электрон уже не связан с ядром, становится свободной частицей.
Свободное состояние электронаэто состояние с положительной энергией электрона.
На рисунке показано свободное состояние электрона с кинетической энергией .В свободном состоянии скорость электрона и его кинетическая энергия может быть любой. Энергетический спектр свободных состояний непрерывен.
Двигаясь по орбите ядра электрон связан с атомом, находиться в связанном состоянии. Связанное состояние электрона — энергетическое состояние с отрицательной энергией.
Скорость движения электрона по n-ой орбите можно найти, по формуле.
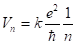
(2.27).
Скорость электрона максимальная на первой боровской орбите 2200 км/с (средняя скорость вращения Земли вокруг Солнца составляет 30 км/с). На рис. 11 дана схема возможных для атома водорода орбит, причем приведены лишь первые четыре. Скорость вращения электрона на второй из них вдвое меньше, чем на первой, на третьей — втрое меньше и т. д.
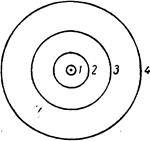
Рис. 10.Возможные электронные орбиты атома водорода
Работа, которую необходимо затратить для вырывания электрона водородного атома с той или иной орбиты, обратно пропорциональна квадрату ее главного квантового числа. Поэтому, например, вырвать электрон с третьей орбиты в девять раз легче, чем с первой.
Если сообщить водородному атому достаточную энергию, то происходит его ионизация — распад на электрон и протон. Энергия, которую нужно для этого затратить, отвечает n = и называется энергией ионизации. Она определена из спектра и для нормального состояния атома водорода составляет 1311 кДж на моль.
Н + 1311 кДж = Н + е По соотношению I = 1311/n2 энергия ионизации может быть рассчитана и для возбужденных состояний атома водорода.
Излучение и поглощение света.
Согласно второму постулату Бора возможные частоты излучения атома водорода определяются формулой.
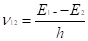
(2.28).
Теория Бора приводит к количественному согласованию с экспериментом для частот, излучаемых атомом водорода. Все частоты излучений атома водорода образуют ряд серий, каждой из которых соответствует определенное значение числа n и различные значения числа к>n Используя постулаты Бора и соотношение с = ln между скоростью, длиной волны и частотой, можно описать и вывести эмпирическую формулу, найденную Бальмером для его серии линий.
Энергия электрона в атоме складывается из его кинетической и потенциальной кулоновской энергии взаимодействия с ядром.
Потенциальная энергия взаимодействия определяется.
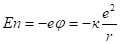
(2.29).
Кинетическая энергия электрона в атоме рассчитывается по формуле.
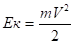
(2.30).
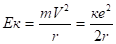
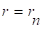
где (2.31).
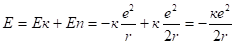
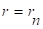
где (2.32).
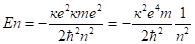
(2.33).
По второму постулату Бора.
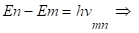
(2.34).
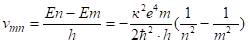
(2.35).
Если учесть взаимосвязь между скоростью и длиной волны, то можно получить.
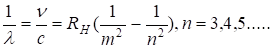
(2.36).
где RH — постоянная Ридберга, численно равная.
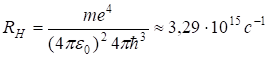
(2.37).
Значение RH, найденное Бальмером, составляло 10 967 776 м-1; используя имевшиеся в то время значения m, e, c и h, Бор получил RH = 1,03?107 м-1. Современное значение RH составляет 10 979 708 м-1. Таким образом, соответствие теории Бора с экспериментом достаточно хорошее. Расхождение в величине RH объясняется неточностью значений фундаментальных констант m, e, c, h, которыми пользовался Бор, а также необходимостью учета ряда поправок, главной из которых является поправка на движение ядра.
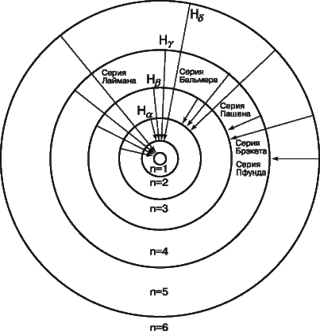
Рис. 11. Атом водорода.
Изображены шесть круговых орбит, отвечающих стабильным энергетическим уровням отдельного электрона. Приведены также различные серии спектральных линий, соответствующие переходам с одной орбиты на другую.
Если вычислить частоты излучений, возникающих при перескоках электрона с одних орбит на другие, оказались совпадающими с частотами линий наблюдаемого на опыте водородного спектра. Как видно из рис. 10, скачками с различных более удаленных от ядра орбит на отвечающую n = 1 соответствуют линии серии, лежащей в ультрафиолетовой области, перескокам на орбиту с n = 2— линии серии Бальмера (рис.10), а перескокам на орбиты с n = 3, 4 и 5 — линии трех серий, лежащих в инфракрасной области. Две последние серии были обнаружены экспериментально уже после разработки теории водородного атома и именно на основе ее предсказаний.
На рис. 12 показано, как выглядят линии серии Бальмера на фотопластинке спектрографа. Нетрудно видеть, что линии сгущаются вблизи границы серии.

Рис. 12. Спектральные линии водорода H и ртути Hg.
Обозначения линий соответствуют переходам, показанным на рис.14; эти линии составляют часть серии Бальмера. Поглощение света — процесс обратный излучению атома. Атом поглощает свет, переходит из низших состояний в высшие. При этом он поглощает фотон той же частоты, которые излучает, переходя из высших энергетических состояний в низшие. Успехи теории атома водорода были получены ценой отказа от фундаментальных положений классической механики, которая на протяжении 200 лет считалась, безусловно, справедливой. Поэтому большое значение имело прямое экспериментальное доказательство справедливости постулатов Бора, особенно первого постулата о стационарных состояниях. Существование стационарных состояний было доказано в опытах Дж. Франк (1882−1964) и Г. Герц (1887−1975), в 1913 году. Идея опыта такова: для обнаружения стационарных состояний нужно исследовать поведение атома при передаче ему определенного количества энергии. Если стационарных состояний нет, то есть если внутренняя энергия может принимать любые значения, то, передавая атому некоторое количество энергии, мы обязательно возбудим атом, то есть увеличим его внутреннюю энергию. Если же стационарные состояния есть, то для увеличения внутренней энергии ему нужно передать энергию, превышающую разность энергий двух низших стационарных состояний. При передаче меньшей энергии атом не возбуждается и передаваемая ему энергия увеличивает лишь кинетическую энергию атома как целого.
Проще всего передать атомам определенную энергию, бомбардируя их электронами, ускоренными электрическим полем. Пройдя разность потенциалов U, электрон приобретает кинетическую энергию.
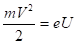
(2.38.).
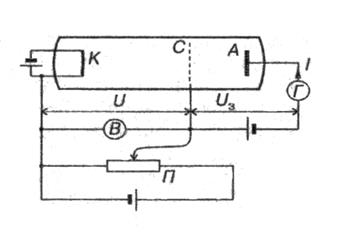
Рис. 13 Cхема экспериментальной установки.
Зависимость силы тока I в цепи анода измеряемая гальванометром Г от напряжения U между катодом и сеткой, измеряемый вольтметром V.
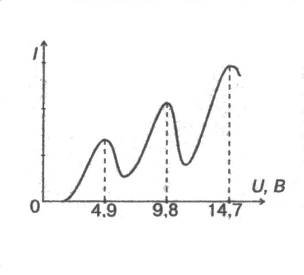
Рис. 14.Результаты измерения опыта Дж. Франка и Г. Герца
Схема экспериментальной установки показана на рисунке (13). Стеклянный сосуд с тремя электродами заполнен парами ртути при низком давлении. Батарея Б 1 создает ускоряющее электрическое поле. Напряжение U между катодом К и сеткой С можно регулировать с помощью потенциометра. Между сеткой и анодом с помощью батареи Б 2 создается слабое задерживающее поле (задерживающее напряжение около 0,5 В). Это препятствует попаданию на анод медленных электронов. Испускаются электроны катодом К, подогреваемым электрическим током.
Экспериментально определяется зависимость силы тока I в анодной цепи от напряжения U. Полученная кривая изображена на рисунке (14).Сила тока достигает первого максимума при напряжении 4,9 В. Затем следует резкий спад силы тока. Следующий максимум получается при напряжении 9,8 В и так далее. Объяснить такую зависимость I от U можно лишь наличием стационарных состояний у атомов ртути.
При напряжении 4,9 В столкновение электрона с атомами являются упругими. Внутренняя энергия атомов не меняется. Кинетическая энергия электронов при этом практически не меняется, так как масса электрона много меньше массы атомов ртути. В результате электроны, ускоренные электрическим полем между катодом и сеткой, преодолевают задерживающее поле и достигают анода. Число электронов, достигших анода в единицу времени, растет пропорционально напряжению.
Когда напряжение повышается до 4,9 В, столкновения электронов с атомами становятся неупругими. Внутренняя энергия атомов увеличивается скачком, а электрон после соударения теряет почти всю свою кинетическую энергию. Задерживающее поле не допускает медленные электроны до анода, и сила тока резко уменьшается. Ток не падает до нуля потому, что некоторая часть электронов достигает сетки, не испытав неупругих соударений.
Необходимую для неупругого соударения энергию электрон приобретает после прохождения разности потенциала 4,9 В. Отсюда следует, что внутренняя энергия атома ртути не может измениться на величину, меньшую чем эВ. Таким образом, внутренняя энергия атома не может изменяться на произвольные значения. Это служит подтверждением существования у атома дискретного набора стационарных состояний.
Справедливость этого вывода подтверждается еще и тем, что при напряжении 4,9 В пары ртути начинают излучать. Частота излучения, вычисляется по формуле.
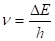
(2.39.).
Совпадает с экспериментально наблюдаемой. Это означает, что возбужденные атомы ртути переходят затем в низшее энергетическое состояние и излучают световые кванты в соответствии со вторым постулатом Бора.
Теория Бора позволила объяснить и происхождение рентгеновского излучения (X-лучей): это излучение испускается в результате выбивания (бомбардирующим атом электроном) электрона с внутренней орбиты атома: на освободившееся место переходят электроны с внешних оболочек атома. Поскольку энергия при этом изменяется значительно больше, чем при оптическом переходе, рентгеновское излучение оказывается более коротковолновым, нежели видимый свет, и более проникающим. Теория Бора объяснила не только линии Бальмера, наблюдаемые в видимой части спектра, но и другие серии линий в ультрафиолетовой (серию Лаймана) и инфракрасной (серию Пашена) области, которые были обнаружены с помощью фотографических методов. Хотя масса M ядра водорода (протона) значительно больше массы электрона, движущегося по орбите в атоме, было бы неправильным считать, что в этой «динамической» модели атома протон покоится. Как указал А. Зоммерфельд (1868−1951), в силу законов сохранения энергии и импульса ядро и электрон должны вращаться относительно общего центра масс с одинаковой угловой скоростью (при этом ядро расположено гораздо ближе к центру масс). Влияние этого движения ядра на энергию электронных состояний можно учесть, просто заменив массу электрона m «приведенной массой» .
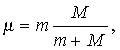
где M — масса ядра рассматриваемого атома. В случае водорода величина m меньше m на 1/1837. Однако точность спектроскопических измерений такова, что такая поправка заметно улучшает согласие теории с экспериментом.
Эффектной демонстрацией возможностей модифицированной теории Бора для атома водорода явилось открытие «тяжелого водорода» (дейтерия) 2Н. Масса ядра дейтерия почти вдвое превышает массу протона, и хотя дейтерий составляет всего 1/4500 часть обычного газообразного водорода, его наличие проявляется на фотоснимках спектра, сделанных с высоким разрешением, в виде очень слабых линий, сдвинутых относительно основных линий из-за различия в величине m. После того как Ф. Астон (1977;1945) обнаружил в 1931 очевидное расхождение в значениях атомной массы водорода, Р. Бёрдж (1887−1980) и Д. Менцель выдвинули гипотезу о существовании двух разновидностей водорода с разными массами изотопов. В 1932 Г. Юри (1893−1981), Дж. Мерфи и Ф. Брикведде (1903;1989) провели серию экспериментов, в которых спектр водорода фотографировался с помощью вогнутой дифракционной решетки радиусом 6,4 м. Они обнаружили слабые дейтериевые линии там, где их предсказывали (длина волны, отвечающая линии Ha, была смещена на 179,3 нм), и, взяв образцы, обогащенные тяжелым изотопом, получили не вызывающие сомнения яркие линии. Дальнейшее развитие теории водородного атома было дано Зоммерфельдом (1916 г.), показавшим, что кроме круговых орбит электрон может двигаться и по эллиптическим (с ядром в одном из фокусов эллипса), причем почти одинаковому уровню энергии соответствует столько возможных типов орбит, сколько единиц в главном квантовом числе. Последнее определяет размер большой полуоси данного семейства эллипсов (в частном случае круга его радиус). Величина малой полуоси определяется «побочным» квантовым числом, которое также принимает значения последовательных целых чисел, но не может быть больше главного. Для большой полуоси эллипса действительно соотношение а = n2r, а для малой b = nkr, где r — радиус орбиты при нормальном состоянии атома (53 пм). Например, для главного квантового числа 3 возможны три типа эллипсов, характеризующиеся обозначениями 31, 32 и 33, которые показывают, что большая полуось относится к малой соответственно как 3: 1, 3: 2 и 3: 3. В последнем случае имеем частный вид эллипса — круг, который один только и рассматривался первоначальной теорией.
Модель возможных электронных орбит атома водорода по Зоммерфельду показана на рис. 15. Произведенное Зоммерфельдом уточнение модели водородного атома позволило объяснить тонкую структуру спектральных линий.
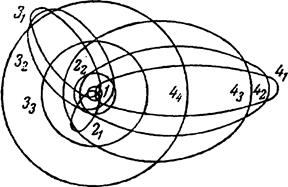
Рис. 15. Схемы относительных энергетических уровней круговых и эллиптических орбит
Именно они и будут в первую очередь заполняться электронами при построении нового слоя в многоэлектронных атомах. Сами электронные слои (т. е. совокупности электронов с одинаковым значением главного квантового числа) в порядке удаления от ядра часто обозначаются буквами L, М, Л*, О, Р, Q.
У тяжелых атомов линии видимого спектра обусловливаются перескоками лишь самых внешних электронов, тогда как при перескоках в более глубоких слоях получаются линии, отвечающие ультрафиолетовым или рентгеновским лучам. Энергия ионизации для этих атомов понимается как энергия, необходимая для удаления наименее прочно связанного электрона, каковым является один из занимающих самые внешние орбиты.
Работу отрыва электрона от атома часто выражают путем указания его ионизированного потенциала. Под последним понимается то минимальное напряжение электрического поля в вольтах, при котором ускоряемый этим полем свободный электрон становится способным вызывать ионизацию данного атома (выбивая его внешний электрон). Например, ионизационный потенциал атома водорода равен 13,595 эВ Ионизационному потенциалу численно равна энергия ионизации, измеряемая в электрон-вольтах (эВ), а переход от них к тепловым единицам дается соотношением: эВ=23,06 ккал/моль. Таким образом, работа ионизации атомов могут быть по желанию выражены и в тепловых единицах (ккал/моль), и в электрон-вольтах (эВ).
Зоммерфельд, указал на то, что круговые орбиты — это лишь частный случай и что постулаты Бора могут быть введены и в случае эллиптических орбит. (При движении по эллиптической орбите скорость наряду с азимутальной имеет и радиальную составляющую. При этом движение происходит в одной плоскости, а центр притяжения располагается в одном из фокусов.).
Недостатки теории Бора.
Наибольший успех теория Бора имела применительно к атому водорода, для которого оказалось возможным построить количественную теорию спектра.
Однако построить количественную теорию для следующего за водородом атома гелия не удалось, теория Бора позволяла лишь делать лишь качественные, хотя и очень важные заключения.
Это неудивительно, так как теория Бора является половинчатой, внутренне противоречивой. С одной стороны при построении атома водорода используются обычные законы механики Ньютона и закон Кулона, а с другой — вводятся квантовые постулаты. Идея квантования порождала первоначально серьезные сомнения, было подмечено, что эта идея внутренне противоречива. Можно выделить несколько недостатков теории Бора.
1. Как электрон может знать, фотон какой частотой он должен поглотить, когда он переходит из одного стационарного состояния в другое.
Поясним отмеченную трудность. Пусть электрон находится на уровне (рис); чтобы перейти на уровень, электрон должен поглотить квант излучения (фотон) с определенной энергией, равной. Поглощение фотона с любой другой энергией не может приводить к указанному переходу и по этой причине оказывается невозможным (для простоты рассматриваются только два уровня). Возникает вопрос, каким образом электрон производит «выбор» нужного фотона из падающего потока фотонов разной энергии? Ведь чтобы выбрать нужный фотон, электрон должен уже знать о втором уровне, то есть побывать на нем, электрон сначала должен поглотить наружный фотон. Возникает замкнутый логический круг. Нарушаются причинно-следственные связи.

- 2. Дополнительные противоречия обнаруживаются при рассмотрении скачка электрона с одной орбиты в атоме на другую. Сколько бы ни был быстр переход электрона с орбиты одного радиуса на орбиты другого радиуса, в любом случае он должен происходить в течении конечного промежутка времени (иначе пришлось бы вступить в противоречия с основными требованиями теории относительности). Но тогда не понятно, чему должна равняться энергия электрона в течение этого промежутка времени — ведь электрон уже не находиться на орбите, которой отвечает энергия, и в тоже время он еще не прибыл на орбиту, которой отвечает энергия. Бор не сумел объяснить, что происходит с электроном в процессе его перехода
- 3. Правило квантования Бора оказалось приближенным следствием, применяемым далеко не всегда, так как в общем случае нарушается закон сохранение момента импульса.
Представление об определенных орбитах, по которым движется электрон в атоме Бора, оказалось весьма условным. На самом деле движение электрона в атоме имеет очень мало общего с движением планет по орбитам. Если бы атом водорода в наинизшем энергетическом состоянии можно сфотографировать с большей выдержкой, то можно было бы увидеть облако с максимальной плотностью на определенном расстоянии от ядра. Это расстояние можно принять за грубое подобие боровского радиуса.
Постулаты Бора оказались совершенно правильными. Но они выступали не как постулаты, а как следствия основных принципов этих теорий. В подобной ситуации был лишь один выход, ввести какие-то новые идеи, которые вместе с идеей дискретности образовали бы непротиворечивую в целом схему. Такой новой физической идеей и явилась идея корпускулярно-волнового дуализма.
Корпускулярно-волновой дуализм.
Начиная с середины 20-х годов прошлого века, в развитии учения о строении атомов наметился перелом, обусловленный влиянием новой физической концепции (т. е. познавательной идеи), выдвинутой в 1924 г. Де Бройлем. Де Бройль предположил следующее, что с каждым микрообъектом связывается с одной стороны корпускулярные характеристики (энергию и импульс), а с другой волновые характеристики длина волны и частота .
Было известно, что фотон излучается и поглощается в виде дискретных порций, энергия которых связана с частотой формулой.
. (2.40).
В тоже время соотношение между энергией и импульсом фотона имеет вид.
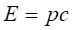
(2.41).
Вмести, эти соотношения дают.
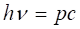
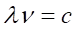
но (2.42).
Отсюда де Бройль получил связь между длиной волны и импульсом:
(2.43).
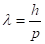
для объекта волнового типа — фотона, который излучается и поглощается определенными порциями.
Далее де Бройль предположил, что со всеми объектами не зависимо от того какого они типа волнового или корпускулярного, связана определенная длина волны, выражающаяся через их импульс по той же формуле. Что это за волна де Бройль еще не знал. Однако если предположить, что электрон в некотором смысле обладает какой-то длиной волны, то мы получим из этого предположения некоторые следствия.
Пользуясь уравнением, можно подсчитать массу кванта лучистой энергии, отвечающего любой длине волны. Вместе с тем можно вычислить длину волны, характерной для частицы с любой заданной массой и скоростью. Например, отвечающей линии серии Бальмера.
Гипотеза де Бройля вскоре нашла прямое экспериментальное подтверждение: оказалось, что направленный на кристалл пучок электронов испытывает дифракцию подобно рентгеновским лучам. Немного позднее то же самое было установлено для атомов водорода и гелия. Так как дифракция является характерным свойством волн, приведенные результаты убедительно подтверждают правильность рассматриваемых представлений.
Утверждается, что волновые свойства электрона позволяют вывести условие квантования момента импульса, которые постулируются в теории Бора.
Этот вывод делается следующим образом, предположим, что на стабильных орбитах укладывается целое число длин волн, выполняется условие существования стоячих волн. Стоячие волны неподвижны и сохраняют свою форму со временем. При заданных размерах колеблющейся системы они обладают лишь определенными длинами волн.
Предположим, что разрешенными орбитами в атоме водорода являются только те, для которых выполнены условия существования стоящих волн. Для этого на длине орбиты должно укладываться целое число длин волн, то есть.
(2.44).
Но связанная длина волны выражается через его импульс по формуле (2.43).
Тогда выражение (2.44) можно записать в виде.
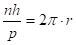
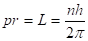
или (2.45).
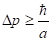
В результате получается условие квантования Бора. Однако продемонстрированный здесь вывод нужно признать несостоятельным. Его можно применить только для грубо качественных объяснений в школе. В нем допущена принципиальная ошибка: в основу положено неверное предположение, будто электрон имеет определенную длину волны де Бройля, или, иначе говоря, определенный импульс. Однако согласно, соотношению неопределенности (), импульс микрообъекта в связанном состоянии характеризуется неопределенностью .
Поскольку в приведенном выше примере, то, следовательно, импульс по порядку величины такой же, что и диктуемая соотношением не определенность импульса. Ясно, что в таких условиях, нельзя говорить о каком либо значении импульса электрона (а соответственно и дебройлевской длине волны) даже приблизительно. Приведенный пример демонстрирует явное преувеличение волнового аспекта, а электрон не может быть не волной не частицей, микрообъект является специфическим объектом способным проявлять в той или иной мере корпускулярные и волновые свойства. Поэтому нельзя таким образом получить условие квантования Бора, всеобщая модель квантового микрообъекта невозможна.
Развивавшаяся на базе этих представлений волновая механика подходит к вопросу о строении атомов с точки зрения характерного для нее принципа неопределенности (Гейзенберг, 1925 г.). Согласно последнему характер движения электрона принципиально не может быть точно фиксирован. Постулируя стационарные состояния, теория Бора не объяснила, почему электрон, двигаясь ускоренно, не излучает и не падает на ядро. Соотношение неопределенности это объясняет. Падение электрона на ядро означало бы очевидно, существенное уменьшения неопределенности его координаты: если до падения на ядро электрон локализован в пределах атома, то есть в области пространства, линейные размеры которого порядка см, то после падения на ядро электрон должен был локализоваться в области с линейными размерами меньше см. Согласно, более сильная локализация микрообъекта в пространстве связана с «размытием» его импульса, поэтому при падении на ядро среднее значение импульса электрона должно возрасти, для чего требуется затраты энергии. Получается, что нужно усиление не для того, чтобы удержать электрон от падения на ядро, а наоборот — нужно усиление, чтобы «заставить» электрон локализоваться в пределах ядра.
Модельное представление об атоме с его определенными орбитами электронов должно быть, поэтому заменено квантовомеханическим описанием, при котором оценивается лишь вероятность нахождения электрона в том или ином месте пространства.
Сама оценка этой вероятности производится хотя и с учетом структурных данных, но чисто математическим путем, при помощи волнового уравнения (Шредингер, 1926 г.), заменившим второй закон Ньютона. Последнее имеет характер постулата, истинность которого (в отличие от теоремы) устанавливается не выводом или прямым доказательством, а соответствием вытекающих из него следствий данным опыта.
Рис. 17 показывает распределение вероятностей нахождения электрона на том или ином расстоянии от ядра при различных квантовых состояниях атома водорода. Как видно из рисунка, при равенстве побочного и главного квантовых чисел (к =n)
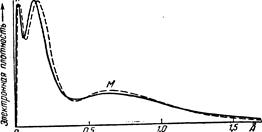
Рис. 17. Распределение вероятностей нахождения электрона в атоме водорода.
положения максимальных вероятностей приблизительно соответствуют радиусам круговых орбит теории Бора-Зоммерфельда. Для эллиптических орбит на определенных расстояниях от ядра появляются уже не только максимумы, но и минимумы вероятности, т. е. в атоме образуются отдельные зоны с различной «плотностью электронного облака» .
Подобный способ выражения вероятности нахождения электрона с помощью как бы «размазывания» его и оценки плотности получаемого таким образом «электронного облака» особенно удобен, при волно-механическом рассмотрении многоэлектронных атомов. Сплошная линия на рис. 17. дает теоретически рассчитанное распределение электронной плотности для атома аргона. Как видно из рисунка, определенным электронным слоям (К, М) теории Бора — Зоммерфельда отвечают максимумы кривой. Однако значительная плотность электронного облака (т. е. вероятность нахождения электрона) существует и между слоями. Последние, таким образом, сколько-нибудь четко друг от друга не отграничиваются. Пунктиром показаны результаты проверки теоретического распределения путем расчета электронной плотности на основе экспериментальных данных по рассеиванию аргоном электронов. Как видно из рисунка, обе кривые практически совпадают.
Квантово-механический подход к атомным проблемам позволил разрешить ряд вопросов, остававшихся ранее неясными, а также получить некоторые количественные результаты со значительно большей точностью, чем удавалось раньше.
Необходимо подчеркнуть, что волновая механика отнюдь не исключает корпускулярную трактовку явлений. Более того, сами ее уравнения основаны на представлении об электроне, как о точечном заряде, а не зарядовом облаке. «К волновому и корпускулярному описанию следует относиться как к равноправным и дополняющим друг друга точкам зрения на один и тот же объективный процесс. Таким образом, квантовая теория Бора, дополненная более точной механикой орбитального движения Зоммерфельда, оказалась способной объяснить широкий круг явлений. Стало понятным существование серий спектральных линий водорода, наличие их тонкой структуры, характеристики неупругого рассеяния электронов в газах и изотопическое смещение спектральных линий. Кроме того, удалось точно вычислить потенциал ионизации водорода (энергию, необходимую для выбивания электрона из атома). Однако трудности все же остались. Теория Бора давала хорошие результаты в случае одноэлектронных атомов типа водорода, однократно ионизованного гелия, дважды ионизованного лития, а также, например, натрия (благодаря тому, что в атоме натрия есть один слабо связанный электрон, который в основном и определяет как спектр, так и химические свойства натрия), но она плохо описывала обычный атом гелия с двумя электронами и другие многоэлектронные атомы. Неудачными оказались также попытки Бора объяснить хорошо известные изменения химических и физических свойств при переходе от атома к атому. Наконец, и постулаты Бора, например, квантование момента импульса на электронных орбитах, выглядели совершенно произвольными.
Дело в том, что в то время были неизвестны два положения, без которых понять строение сложных атомов невозможно, — принцип запрета Паули и существование у электрона спина. Эти положения наряду с созданием новой механики, названной волновой, или квантовой, были необходимы для полного понимания строения атома. Недостатки теории Бора, основанной на механике классических частиц с дополнением в виде квантовых постулатов, высветили фундаментальную проблему правильного описания движения электронов на малых расстояниях, например, внутри атома. Опираясь на то, что свет имеет как корпускулярные, так и волновые свойства (в некоторых явлениях, например, при фотоэффекте, он ведет себя как поток частиц, а в некоторых, например, при интерференции, как волна). В настоящее время электронная структура атомов в принципе получила свое объяснение, хотя свойства многоэлектронных атомов удается рассчитать лишь приближенно. Квантовая механика объясняет все известные свойства отдельных атомов. Активно изучается взаимодействие атомов, особенно в твердых телах, о чем свидетельствует успехи физики твердого тела и микроэлектроники, наноэлектроники.