Краткие теоретические основы хроматографического разделения смеси веществ
Из-за различия в значении К индивидуальные вещества перемещаются по колонке с разной скоростью, и благодаря этому достигается их разделение. В зависимости от природы твердого носителя и свойств жидкой неподвижной фазы, а также способа проведения эксперимента распределительная хроматография делится на колоночную, бумажную и тонкослойную. В колоночной и тонкослойной распределительной хроматографии… Читать ещё >
Краткие теоретические основы хроматографического разделения смеси веществ (реферат, курсовая, диплом, контрольная)
Адсорбционная хроматография. Адсорбционная хроматография основана на различии в адсорбционных свойствах компонентов разделяемой смеси.

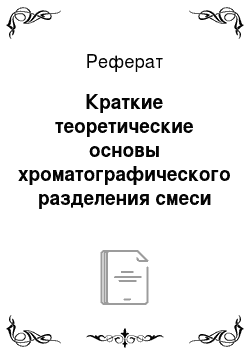
Рис. 75. Изотерма адсорбции.
На поверхности твердого адсорбента имеются активные участки, свободное силовое ноле которых способно фиксировать молекулы посторонних веществ. Во время хроматографирования происходит непрерывный процесс сорбции и десорбции растворенного вещества на поверхности сорбента. Когда число частиц, адсорбирующихся на поверхности в единицу времени, становится равным числу частиц, покидающих поверхность (скорость сорбции равна скорости десорбции), наступает состояние адсорбционного равновесия. В состоянии равновесия каждой концентрации адсорбируемого вещества в подвижной фазе отвечает определенное количество его на адсорбенте. Зависимость количества адсорбированного вещества от его концентрации в момент равновесия при постоянной температуре выражается изотермой адсорбции Фрейндлиха и Лангмюра (рис. 75), которая описывается уравнением п = ась, где п — количество вещества, адсорбированное единицей поверхности, а и b — величины, постоянные для данной системы (адсорбируемое вещество — адсорбент). Из формы кривой изотермы адсорбции следует, что увеличение концентрации раствора выше определенного значения не вызывает увеличения количества адсорбированного вещества. Поэтому наибольшая эффективность метода достигается при пропускании через сорбент разбавленных растворов.
Чем лучше адсорбируется вещество, тем круче адсорбционная кривая, тем меньше скорость продвижения вещества по колонке или слою адсорбента. Поэтому отдельные компоненты смеси движутся через адсорбент с различной скоростью. Чем хуже адсорбируется вещество, тем быстрее оно продвигается по колонке в процессе хроматографирования.
Выбор адсорбента и растворителя. Главное требование, предъявляемое к адсорбенту для хроматографии, — отсутствие химического взаимодействия между адсорбентом и анализируемыми веществами. Адсорбент не должен также оказывать каталитического действия как на растворитель, так и на вещества разделяемой смеси. Одно из средств уменьшения каталитического действия адсорбентов — тщательная очистка адсорбента от примесей, нейтрализация кислотных или основных его свойств. Каталитическое окисление можно устранить, проводя процесс в атмосфере инертного газа. Второе важнейшее требование к адсорбенту — его избирательность, т. е. возможно большее различие в адсорбируемости веществ разделяемой смеси. Адсорбенты разделяют на полярные и неполярные. Адсорбционное сродство полярных веществ к полярным адсорбентам значительно выше, чем неполярных к полярным. Немалое значение имеет степень дисперсности адсорбента. Наконец, чрезвычайно важна стандартность свойств адсорбента, что обусловливает воспроизводимость и возможность сопоставления результатов эксперимента.
В настоящее время в хроматографических работах применяются почти исключительно адсорбенты заводского производства.
Один из наиболее часто применяемых адсорбентов — оксид алюминия, на котором удается хроматографировать весьма широкий круг смесей веществ как в полярных, так и в неполярных растворителях благодаря ее амфотерному характеру. Технический оксид алюминия имеет слабощелочную реакцию (рН9—10). Нейтральный оксид алюминия можно приготовить, промывая технический продукт разбавленной азотной или соляной кислотой. Активность оксида алюминия зависит от ее влагосодержания. Увлажняя наиболее активную форму оксида алюминия (1-я степень активности) различным объемом воды, можно получить набор адсорбентов с различной активностью[1]. Широко применяются в хроматографии силикагели различных марок для хроматографического разделения смесей нефтепродуктов, высших жирных кислот и их сложных эфиров, нитрои нитрозопроизводных, ароматических аминов и других органических соединений. Нейтральный силикагель, который получают промыванием дистиллированной водой промышленного силикагеля, используют при хроматографировании нестабильных веществ. Несколько меньшее применение находят активированные угли, гидроксид кальция, силикаты кальция и магния, оксид магния, гипс, сульфат магния, кизельгур, целлюлоза и др.
К числу особенно интересных сорбентов относятся природные и синтетические вещества, получившие название молекулярных сит. Это мелкие пористые кристаллы природных и синтетических минералов — цеолитов. Поры таких кристаллов имеют размеры, близкие к размерам молекул жидких или газообразных веществ (0,8—0,2 нм). Те вещества, молекулы которых по своим размерам могут проникнуть в эти поры, сорбируются в кристаллах цеолитов, а более крупные молекулы остаются несорбированными. Использование цеолитов с различными размерами пор дает возможность очень четко разделить на цеолитах смеси различных веществ. Природные цеолиты — довольно большая группа минералов, являющихся водными алюмосиликатами кальция, натрия и некоторых других металлов (см. с. 32).
Цеолиты значительно превосходят по величине внутренней удельной поверхности некоторые широко применяемые адсорбенты, например оксид алюминия.
В какой-то мере выбор сорбента может быть предсказан заранее. На практике в первую очередь нужно исходить из свойств разделяемых соединений: их растворимости (гидрофильность, гидрофобность), содержания и характера функциональных групп. Насыщенные углеводороды адсорбируются слабо или совсем не адсорбируются.
Введение
двойных связей, особенно сопряженных, увеличивает адсорбционную способность соединений. Функциональные группы еще в большей степени усиливают способность вещества к адсорбции. Адсорбционная способность функциональных групп увеличивается в следующем порядке:

Если присутствует несколько заместителей, то эта закономерность может изменяться.
Правильный выбор растворителя в адсорбционной хроматографии имеет существенное значение и тесно связан как с природой выбранного адсорбента, так и со свойствами компонентов анализируемой смеси. В связи с этим представляет.
Растворитель. | Диэлектрическая проницаемость. | Растворитель. | Диэлектрическая проницаемость. |
Вода. | 80,0. | Диоксан. | 8,9. |
Метиловый спирт. | 31,2. | Хлороформ. | 5,2. |
Этиловый спирт. | 25,8. | Метиленхлорид. | 2,2. |
и-Пропиловый. | 22,8. | Бензол. | 2,3. |
спирт. | Толуол. | 2,3. | |
Ацетон. | 21,5. | Трихлорэтилен. | 3,4. |
Дихлорэтан. | 10,4. | Тетрахлорид. | 2,2. |
Этилацетат. | 6,1. | углерода. | |
Амилацетат. | 5,1. | Циклогексан. | 2,0. |
Этиловый эфир | 4,4. | Петролейный эфир (фракция 35—50 °С). | 1,9. |
интерес элюотропный ряд Траппе (табл. 5), в котором наиболее часто применяемые в хроматографии растворители расположены в порядке убывания десорбирующей способности с полярных адсорбентов. Десорбирующая способность растворителей хотя и не строго, но зависит от их диэлектрической проницаемости (диэлектрическая постоянная). Для неполярных адсорбентов десорбирующая способность приведенных в таблице растворителей изменяется в обратном порядке.
В табл. 6 приведен список растворителей и адсорбентов, наиболее часто применяемых для разделения растворов смесей веществ методом адсорбционной хроматографии.
Распределительная хроматография. Распределительная хроматография основана на различии в коэффициентах распределения компонентов разделяемой смеси между двумя несмешивающимися жидкостями, в которых компоненты растворяются, причем одна из жидкостей (неподвижная фаза) удерживается твердым носителем (по возможности инертным).
Растворители должны прежде всего хорошо растворять все компоненты анализируемой смеси, минимально адсорбироваться на выбранном адсорбенте, не взаимодействовать химически ни с анализируемым веществом, ни с адсорбентом. Выбор растворителей определяется тем, что они в значительной степени влияют на прочность адсорбции. Чем больше полярность адсорбируемого вещества по сравнению с растворителем, тем прочнее оно связывается с адсорбентом. Наоборот, если степени адсорбции вещества и растворителя близки, то адсорТаблица 6. Растворители и адсорбенты, наиболее часто применяемые в жидкостной адсорбционной хроматографии.
Разделяемые смеси. | Растворители. | Адсорбенты. |
Углеводороды. | Пентан, петролейный эфир, бензин, изооктан, хлороформ, тетрахлорид углерода, хлорбензол, этиловый спирт, ацетон. | Активированный оксид алюминия, силикагели различных марок, алюмосиликатный катализатор |
Галогенопроизводные углеводородов. | Пентан, изооктан, петролейный эфир, тетрахлорид углерода. | Силикагели различных марок, активированный оксид алюминия. |
Спирты. | Изопропиловый спирт, «-бутиловый спирт, диэтиловый эфир, хлороформ, диоксан, бензол, петролейный эфир | Активированный уголь, оксид алюминия, силикагели. |
Фенолы. | Петролейный эфир, бензол, диэтиловый эфир, этиловый спирт. | Оксид алюминия, оксид кальция. |
Альдегиды и кетоны. | Петролейный эфир, бензол, диэтиловый эфир, тетрахлорид углерода, сероуглерод. | Оксид алюминия, оксид магния, тальк, силикагели. |
Карбоновые кислоты. | Бензол, петролейный эфир, этиловый спирт, н-гептан, нитропропан, вода (для низших кислот). | Тальк, активированный уголь, оксид алюминия, силикагели. |
Сложные эфиры. | Петролейный эфир, бензол, диэтиловый эфир, тетрахлорид углерода, хлороформ, н-гексан. | Оксид алюминия, силикагели, активированный уголь. |
Хиноны. | Бензол, н-гексан, этиловый спирт, ацетон, метиловый спирт. | Оксид алюминия, кизельгур |
Амины, амиды. | Петролейный эфир, бензол, тетрахлорид углерода, диэтиловый эфир | Силикагели, оксид алюминия. |
Продолженш
Разделяемые смеси. | Растворители. | Адсорбенты. |
Нитрои нитрозосоединения. | Бензол, петролейный эфир, хлористый метилен. | Тальк, гидроксид кальция, карбонат кальция, силикагели, оксид алюминия. |
Сульфокислоты. | Вода. | Оксид алюминия. |
Сахара. | Вода, изопропиловый спирт, этиловый спирт, н-бутиловый спирт, диоксан, петролейный эфир, бензол, хлороформ. | Боксит, активированный уголь, силикагели, оксид алюминия. |
Аминокислоты. | Вода, метиловый спирт, водный раствор формальдегида, диэтиловый эфир, раствор фенола, л-крезол, хлороформ. | Активированный уголь, силикагели, оксид алюминия, диоксид титана, крахмал. |
Гетероциклические соединения. | Бутиловый спирт, диэтиловый эфир, хлороформ, петролейный эфир, бензол, этиловый спирт, ацетон, 0,004 М раствор соляной кислоты, вода, уксусная кислота. | Оксид алюминия, гидроксид кальция, крахмал, силикагели, кизельгур, карбонат кальция, сахар, тальк. |
Алкалоиды. | Вода, бензол, хлороформ, диэтиловый эфир, этиловый спирт, ацетон, раствор фенола. | Оксид алюминия, силикагели, фуллерова земля. |
Витамины. | Петролейный эфир, бензол, вода, этилацетат, этиловый спирт. | Оксид алюминия, гидроксид кальция, оксид магния. |
Терпены. | Тетрахлорид углерода, петролейный эфир, гексан, бензол, этиловый спирт, ацетон, метиловый спирт, этилацетат, хлороформ. | Оксид алюминия. |
Сероорганические соединения. | Петролейный эфир, изооктан, спиртобензольная смесь, этиловый спирт, ацетон. | Силикагели, оксид алюминия. |
бированное вещество вытесняется молекулами растворителя, и степень адсорбции вещества понижается.
Часто практикуется последовательное вымывание веществ рядом растворителей с постепенно увеличивающейся десорбционной способностью. В результате отдельные компоненты смеси десорбируются и вымываются из колонки последовательно.
Растворитель (так называемая подвижная фаза) продвигается через неподвижную фазу и увлекает разделяемые вещества, находящиеся на носителе. В процессе хроматографирования происходит распределение каждого вещества между подвижной и неподвижной фазами до тех пор, пока не будет достигнуто состояние равновесия. Константа равновесия зависит от выбранных растворителей и от природы хроматографируемого вещества. Эту величину К называют коэффициентом распределения Нернста:

где с1 и с2 — молярные концентрации вещества в обеих фазах.
Согласно закону Нернста для определенного вещества и определенной системы фаз коэффициент распределения есть величина постоянная, не зависящая от концентрации вещества. Изотерма, отвечающая закону Нернста, представляет собой прямую линию, поэтому полоса вещества на распределительной хроматограмме имеет симметричную форму.
Из-за различия в значении К индивидуальные вещества перемещаются по колонке с разной скоростью, и благодаря этому достигается их разделение. В зависимости от природы твердого носителя и свойств жидкой неподвижной фазы, а также способа проведения эксперимента распределительная хроматография делится на колоночную, бумажную и тонкослойную. В колоночной и тонкослойной распределительной хроматографии может быть применен любой твердый носитель, который прочно удерживает неподвижную фазу, легко пропуская подвижную жидкую фазу, и не вызывает побочных явлений (каталитического воздействия на компоненты смеси и т. п.). В качестве таких носителей чаще всего применяют силикагель, кизельгур, гипс, цеолиты, крахмал, целлюлозу, диатомит.
В распределительной хроматографии полярных соединений неподвижной фазой обычно служит вода, а подвижной фазой — не смешивающийся с ней менее полярный органический растворитель, к которому добавляют воду или насыщают его водой. Для разделения неполярных (гидрофобных) веществ применяют обращенную распределительную хроматографию. В этом случае носитель пропитывают неполярными органическими веществами (парафиновое масло, силиконовые масла различной вязкости, тетрадекан и т. п.). Полярной фазой служат полярные органические растворители, которые обычно насыщают неподвижной фазой. Для разделения веществ со средней полярностью в качестве неподвижной фазы применяют некоторые нелетучие полярные жидкости, такие, как формамид, полиэтиленгликоль. Подвижной фазой служат малополярные и неполярные жидкости, в частности хлороформ и гептан, насыщенные неподвижной фазой. Объем растворителя (неподвижной фазы), необходимый для пропитки, должен быть точно определен экспериментально. В качестве носителя неподвижной жидкой фазы в бумажной хроматографии применяют специальную бумагу, способную удерживать в порах много жидкости, являющейся неподвижной фазой.
В распределительной колоночной хроматографии движение зон компонентов разделяемой смеси может быть количественно охарактеризовано величиной RF, называемой подвижностью,.

где S — поперечное сечение колонки; Sn — поперечное сечение подвижной жидкой фазы; SH — поперечное сечение неподвижной жидкой фазы; Кр — коэффициент распределения.
Так как в случае бумажной хроматографии или хроматографии в тонком слое величину RF измерить невозможно, то для характеристики поведения зон в этих случаях вводят величину Rf:

_ *FSn S g.
S Sn + *pS" •.
Величину Rf можно выразить также через смещение зоны при промывании чистым растворителем. В самом деле, смещение зоны х при промывании колонки чистым растворителем, объем которого равен К, может быть определено из уравнения.

откуда Если смещение фронта растворителя обозначить я, то х. опреде.

Рис. 76. Схема определения Rf компонентов смеси по результатам хроматографирования на бумаге.
Rf в идеальном случае лится равенством.

Тогда R{ = x/xf, т. е. R{ равно отношению смещения зоны к смещению фронта растворителя. На рис. 76 дано пояснение этого соотношения. Здесь хх и х2 — пути, пройденные соответственно первым и вторым компонентами разделяемой смеси от начального положения; xf — путь, пройденный фронтом растворителя. Если хх * х2, то и R{ Ф R", следовательно, зоны компонентов разделятся. Величина характеризует скорость продвижения зоны компонента по бумаге и зависит от природы выбранных жидких подвижных и неподвижных фаз. Следовательно, Rf определяется только коэффициентом распределения (который зависит от температуры) и свойствами бумаги или тонкого слоя носителя.
Однако вследствие взаимодействия веществ смеси с носителем, отклонения процесса от равновесия и по другим причинам Rf зависит от природы носителя, техники эксперимента и других факторов и поэтому не является строгой константой.
Коэффициент распределения рассчитывают из экспериментальных данных по уравнению.

где Sn/SH равно отношению объемов жидких фаз.
Значения R{ для компонентов разделяемой смеси должны быть не очень большими, но и не слишком малыми. В первом случае смесь не разделится, а во втором разделение будет идти очень медленно.
Г ель-хроматография. С 1960 г. начал развиваться новый метод хроматографии, получивший название гель хроматографии.
Некоторые полимеры обладают способностью содержать значительное количество прочно связанного растворителя. Если это неполярный растворитель, то гель называется гидрофоб- 79.
ным, а если вода — гидрофильным. Хотя при этом мелкие частицы геля и выглядят сухими, масса содержащегося в них растворителя часто во много раз превышает массу самого геля. Так, например, в сефадексе G-20 на 1 г сухого геля содержится 20 г связанной воды. В качестве гидрофильных гелей используют чаще всего гели из полиакриламида, агар-агара и декстрана, в качестве гидрофобных — гели, которые набухают в органических растворителях. Обычно это этерифицированные декстрановые гели.
Разделение на гелях основано на том, что растворенные вещества распределяются в зависимости от размеров их молекул и размеров пор геля между растворителем, играющим роль подвижной фазы, и тем же самым растворителем, содержащимся в геле (стационарная фаза). Таким образом, разделение oбyqлoвлeнo способностью растворенных частиц проникать в поры геля, т. е. различной способностью их к диффузии. Разделяемые вещества должны иметь очень малое сродство к гелю, чтобы не накладывались адсорбционные взаимодействия.
Гели используются для отделения крупных органических молекул от мелких — гель-фильтрация; для разделения молекул с разной молекулярной массой (отличие должно быть не меньше чем несколько сот единиц атомной массы) — гель-хро матография; для определения молекулярной массы полимеров (обычно групповой анализ). Хроматография на гелях широко используется в биохимических исследованиях.
Ионообменная хроматография. В основе ионообменной хроматографии лежит обратимый обмен ионов, содержащихся в растворе, на подвижные ионы веществ, называемых ионита ми или ионообменниками. Разделение смеси содержащихся в растворе ионов основано на неодинаковой способности их к обмену с ионами ионита. Ионообменники — это нерастворимые высокомолекулярные соединения, содержащие способные к ионизации функциональные группы и дающие с ионами противоположного заряда нерастворимые соли. В зависимости от характера ионизирующих групп иониты подразделяют на катиониты и аниониты. Существуют также амфотерные иониты, способные осуществлять одновременный обмен катионов и анионов. Такие ионообменники носят название амфолитов.
Можно представить, что ионит состоит из каркаса, обладающего положительным или отрицательным зарядом, который компенсируется зарядами ионов противоположного знака (противоионов), так что в целом ионит нейтрален. Способность ионита к обмену обусловливается тем, что противоионы обладают определенной подвижностью в пределах каркаса. Если ионит, содержащий противоионы А, поместить в раствор, в котором находятся ионы В того же заряда, то ионы, А будут покидать ионит и переходить в раствор, а ионы В будут в строго эквивалентном количестве связываться с ионитом:

Анионный обмен:

Здесь R — полимерный радикал, образующий вместе с ионогенной группой каркас ионита, а Ап" и Kt+ — ионогенные группы или фиксированные ионы, обусловливающие заряд каркаса.
Так, например, если через катионит пропускать глицин, загрязненный хлоридом бария, то катионы, вытесняя ионы Н+, будут «садиться» на катионит. Если затем через колонку с этим катионитом пропускать водный раствор аммиака, то аммиак вытеснит глицин, а ионы Ва2+ останутся связанными с катионитом. В выходящем из колонки аммиачном растворе будет находиться очищенный от ионов Ва2+ глицин:

К числу важнейших свойств ионообменников относится их объемная емкость — величина постоянная, определяемая в первую очередь числом фиксированных ионов, т. е. ионов, определяющих заряд каркаса. Объемную емкость обычно выражают в моль-эквивалентах или в миллиграмм-эквивалентах сорбируемого иона на грамм отмытого от сорбированного вещества сухого ионита, находящегося в водородной (для катионита) и хлоридной (для анионита) форме.

Равновесие, устанавливающееся при ионообменных процессах, в первом приближении может быть выражено законом действующих масс. Из уравнения обмена двух одновалентных ионов, А и В Согласно закону действующих масс, следует.

Это уравнение можно написать иначе:

где |А*] и [В+] — концентрации ионов в твердой фазе, а [А^] и [В+] — в подвижной фазе; КА в — коэффициент избирательности, или константа ионного обмена.

Аналогично для реакции обмена двухвалентного иона на одновалентный применение закона действующих масс дает соотношение.

Из приведенных уравнений следует: равновесное отношение концентраций или активностей ионов в твердой фазе является линейной функцией соответствующего отношения в жидкой фазе, разумеется, с учетом заряда ионов.
Откладывая по оси ординат равновесные отношения в твердой фазе, а по оси абсцисс равновесные отношения в растворе, можно получить изотермы ионного обмена. Константа ионного обмена равна тангенсу угла наклона изотермы к оси абсцисс.
Физический смысл константы ионного обмена заключается в том, что она позволяет дать количественную характеристику способности ионита к обмену с различными ионами из раствора. Если КА В > 1, ион раствора имеет большее сродство к иониту, чем ион, первоначально соединенный с ионитом. Обмен из раствора будет протекать достаточно полно. Если АГА в < 1″ ион раствора имеет меньшее сродство, чем ион ионита. Обмен незначителен. Если КАВ = 1, сродство обоих ионов одинаково.
Иониты. Свойствами ионитов обладают многие природные и синтетические вещества. Важнейшие из них — синтетические смолы, угли и некоторые минеральные иониты. Наибольшее практическое значение имеют синтетические органические иониты, получаемые на основе полимерных веществ — синтетических смол. Например, в случае катионита Дауэкс В качестве ионизирующих групп (фиксированных ионов) в катионите присутствуют группы SOj, COO", РО|", AsO|" ;

у анионитов — группы Синтетические ионообменные смолы являются гелями полиэлектролитов, способными к ограниченному набуханию.
Существует классификация ионитов по их отношению к водородным (для катионитов) и гидроксильным (для анионитов) ионам. Первый тип — иониты, проявляющие свойства сильных кислот или сильных оснований. Для катионитов этого типа (КУ-2, КУ-3, СДВ-2, СДВ-3, АР) характерна легкость вытеснения из них ионов водорода другими катионами раствора. Фиксированными ионами в катионитах этого типа чаще всего являются группы —S03H, которые легко диссоциируют на ион структура полимерной молекулы образована цепями сульфированного полистирола, соединенными поперечными мостиками дивинилбензола:

SO3, остающийся в каркасе, и протон. Аниониты первого типа (АВ-16, АВ-17) легко обменивают ионы гидроксила на анионы из раствора. Такие аниониты содержат четвертичные аммониевые основания, легко диссоциирующие на ионы гидрокси;
ла и ионы —NR3, входящие в каркас ионита.
Второй тип — иониты, проявляющие свойства слабых кислот или слабых оснований. Катиониты этого типа содержат группы, характерные для слабых кислот: —СООН, —Si03H, фенольный гидроксил и др. Аниониты второго типа имеют в качестве фиксированных ионов группы —NH3, ^>NH2, -^NH.
Третий тип — иониты смешанного типа, содержащие функции ионитов первого и второго типов.
- [1] Стандартизацию активного оксида алюминия по Брокману см.:часть 2, работа 4.