Анализ литературных данных по исследованию термического разложения алифатических спиртов

Рис. 7 иллюстрирует рост давления на 9.2 МПа при той же температуре за 4 цикла нагрева от 523.15 К до 673.15 К и последующего охлаждения до комнатной температуры. В этой же работе авторы, исследуя р, V, T — свойства водного раствора этилового спирта (0.5 мол. доли), не обнаружили термического разложния молекул спирта. Для выяснения влияния материала пьезометра на степень термического разложения… Читать ещё >
Анализ литературных данных по исследованию термического разложения алифатических спиртов (реферат, курсовая, диплом, контрольная)
метанол изотермический пьезометр
Термическое разложение индивидуальных алифатических спиртов
Термическое разложение (деструкция) молекул индивидуальных алифатических спиртов исследовано различными методами в основном при высоких температурах [53 — 70].
Barnard и Hughes исследовали термическое разложения этанола [53], 1-пропанола [54] и 1-бутанола [55] в диапазоне температур 843 — 902 К и давлений 0.003 — 0.066 МПа в реакторе постоянного объема. Рассмотрены механизмы, рассчитаны константы скорости и энергии активации термического разложения спиртов, определены основные продукты термического разложения этих спиртов. При разложении молекул этанола образовывались водород и ацетальдегид (их больше всего), также угарный газ и метан (схема 1);
С2Н5ОН = СН3СНО + Н2.
СН3СНО = СН4 + СО (1.1).
С2Н5ОН = СН4 + СО + Н2.
1-пропанола — метан и ацетальдегид (их больше всего), также обнаружены угарный газ, водород, формальдегид, этан, этилен, пропан, пропен и вода (1.2);
СН3СН2СН2ОН = СН3СН2 + СН2ОН СН3СН2 = С2Н4 + Н СН2ОН = Н + НСНО НСНО = Н2 + СО (1.2).
СН3СН2СН2ОН + Н = СН4 + СН2СН2ОН СН2СН2ОН = СН3СНО + Н СН3СНО = СН4 + СО.
1-бутанола — формальдегид, монооксид углерода, метан и водород, также в малых количествах обнаружены этан, этилен, пропани пропен. Порядок реакции (кинетический закон, описывающий соответствующий процесс) термического разложения для всех трех спиртов оказался равным единице (1.3).
СН3СН2СН2СН2ОН = СН3СН2СН2 + СН2ОН СН2ОН = Н + НСНО НСНО = Н2 + СО СН3СН2СН2 = СН3 + С2Н4.
СН3 + СН3СН2СН2СН2ОН = СН4 + СН3СН2СН2СНОН (1.3).
СН3СН2СН2СНОН = СН3СН2СН2 + НСНО СН3СН2СН2 = СН3 + С2Н4.
СН3 + СН3СН2СН2СН2ОН = СН3СН2СН2СН (СН3)ОН СН3 + СН3СН2СН2 = СН3СН2СН2СН3.
Авторы [55] утверждают, что полная реакция разложения молекулы 1-бутанола выглядит следующим образом (1.4).
С4Н9ОН = СО + Н2 + СН4 + С2Н4 (1.4).
Fletcher [56] исследовал термическое разложение метилового спирта при температуре 942 К. Описан механизм реакции, в частности, утверждается, что в процессе распада молекулы спирта идет разрыв О-Н связи, а не О-С. В процессе ступенчатой реакции вначале образуются водород и формальдегид, затем (НСНО) разлагается с образованием монооксида (СО) углерода и водорода (Н2) (1.5).
СН3ОН = Н2 + НСНО (1.5).
НСНО = Н2 + СО.
G.R. Freeman [57] исследовал термическое разложение этилового спирта при температуре 798 К. В работе им описан механизм реакции, который имеет следующий вид:
С2Н5ОН = СН3СНО + Н2.
С2Н5ОН = С2Н4 + Н2О (1.6).
Масспектроскопический анализ показал наличие воды, этилена, этана, водорода, угарного газа.
Jasbec и Haynes [58] исследовали термическое разложение метилового спирта в диапазоне температур от 523 — 1023 К при атмосферном давлении. Рассмотрен механизм деструкции молекул метанола при заданных температурах. Определены продукты разложения, которыми являются формальдегид, водород, углекислый и угарный газы, при чем количество формальдегида уменьшается с увеличением температуры (рис. 1).

Рис. 1. Зависимость концентрации продуктов термического разложения метилового спирта от температуры
D. Aronowitz [59] исследовал термическое разложение метилового спирта в диапазоне температур от 1073 — 1225 К при атмосферном давлении. Рассмотрен дватцати ступенчатый механизм разложения метанола. Продуктами разложения являются водород, угарный газ, метан, этан, этилен, формальдегид и ацетилен.
Li J., Kazakov A. and Dryer F. L [60] исследовали термическое разложение этанола при температуре 950 К и давлениях от 0.3 до 1.2 МПа. Рассмотрен механизм разложения молекулы спирта. Основными продуктами разложения являются этилен, вода, ацетальдегид и метан.
G. Rotzoll [61] исследовал термическое разложение этанола в диапазоне температур 1050 — 1275 К. Масспектрометрическим методом определены продукты разложения: этилен и вода (в основном), водород, метан, и угарный газ. Рассмотрен механизм разложения молекулы спирта (1.7), вычислены порядок и константы скорости разложения.
С2Н5ОН = С2Н4 + Н2О С2Н5ОН = СН3СНО + Н2 (1.7).
С2Н5ОН = СН4 + СО + Н2.
На рис. 2 представлена температурная зависимость концентрации продуктов разложения этилового спирта. Угарный газ и вода на рисунке не указаны.
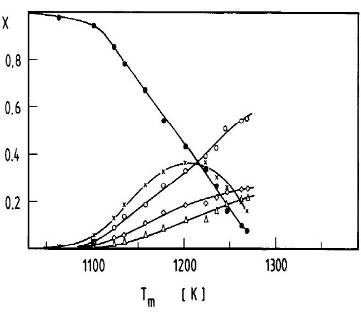
Рис. 2. Зависимость концентрации продуктов разложения этилового спирта от температуры: ?- этанол; _-этилен; Д-метан; ?-водород; Ч-ацетальдегид
M. Peg, M.P. Ruiz, A. Millera, R. Bilbao, и M.U. Alzueta [62] исследовали термическое разложение этанола в диапазоне температур 973 — 1473 К. Продукты разложения определяли хроматографическим методом. В них обнаружено большое количество водорода, угарного и углекислого газов, а также в небольших количествах — метан, этан, этилен и ацетилен. Причем количество водорода, углекислого и угарного газов растет с температурой, а остальных продуктов уменьшается.
Авторами работ [63−65] исследовано термическое разложение метилового спирта в диапазоне температур 1660 — 2050 К [61] и этилового спирта в диапазоне температур 857 — 1359 К [64] в диапазоне температур 1450 — 1760 К [65] и давлений 0.1 — 0.2 МПа и методом нестационарного расширения их сжатых паров до высокого давления (ударная труба). Рассчитаны константы разложения молекул спиртов. Основными продуктами разложения метанола оказались водород и формальдегид, а этанола — этилен и вода.
Yoshiaka Hidaka и Takashi Oki [66] исследовали термическое разложение метанола методом ударной волны в диапазоне температур 1372 — 1842 К. Рассмотрены различные механизмы процесса разложения. Продуктами разложения были формальдегид, водород, угарный газ, метан.
Работы [67−69] посвящены расчетно — теоретическому изучению процесса термического разложения этилового спирта в диапазоне температур 300 — 3000 К. Предложены различные механизмы процесс распада молекул этанола. В частности, в работе [67] утверждается, что в диапазоне температур 700 — 2500 К и давлении ниже 0.1 МПа доминирующим является процесс дегидратации спирта с образованием воды и этилена. При давлениях выше 0.1 МПа и температуре 1050 К идет разрыв С-С связи и образование радикалов СН3 и СН2ОН; механизм разложения при этом цепной. В работе [68] утверждается, что при температурах до 2500 К энергетически выгодным является процесс дегидрирования этанола с образованием водорода и ацетальдегида.
С2Н5ОН = С2Н4 + Н2О С2Н5ОН = СН3 + СН2ОН (1.8).
С2Н5ОН = СН4 + СО + Н2.
В работе [70] проведено экспериментально-теоретическое исследование термического разложения этилового спирта в диапазоне температур 1045 — 1080 К и давлений 0.17 — 0.3 МПа. По результатам хроматографического анализа продуктов разложения (вода, этилен, метан, уксусный альдегид, муравьиный альдегид) предложены различные механизмы расщепления молекул спирта. Утверждается, что больше всего при этих условиях образуются этилен и вода, причем наибольший их выход осуществляется при Т=1050 К и р=0.3 МПа (рис. 3).
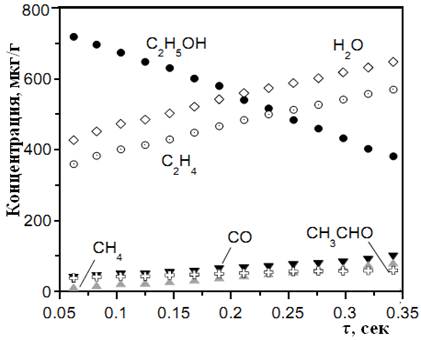
Рис. 3. Зависимость концентрации продуктов разложения этилового спирта от времени при Т=1050 К и р=0.3 МП
Термическое разложение молекул индивидуальных спиртов обнаружено также при исследовании термодинамических свойств при температурах 423.15 — 673.15 K [71−85].
Yerlett T.K., Vine M.D. и Wormald C.J., исследуя молярную энтальпию алифатических спиртов (метанол, этанол, 1-пропанол) методом проточного калориметра в диапазоне температур 373.15 — 573.15 К, обнаружили термическое разложение молекул метанола и этанола [71,72]. Исследуемый спирт находился при температуре опыта в течение 1 часа. Результаты хроматографического анализа метанола при температуре 573,15 К показали наличие в системе ацетона, формальдегида, а также метилового эфира уксусной кислоты [71]. А при анализе продуктов разложения этанола при этой же температуре обнаружены водород и ацетальдегид [72]. Разложение 1-пропанола не обнаружено [73]. С J. Wormald и D. P. Fennell исследовали так же молярную энтальпию 1-бутанола аналогичным методом в диапазоне температур 423.15 — 623.15 К и давлений до 10.2 МПа и не обнаружили термического разложения его молекул [74].
Калафати Д.Д., Рассказов Д. С. и Петров Е. К. [45] отмечают противоречивость литературных данных [75, 76] о границе термической стойкости этилового спирта. В связи с этим ими проведены p, V, Т — измерения этилового спирта, содержащего 6.28% (по массе) воды в диапазоне температур 423.15 — 573.15 К и давлений 1 — 20 МПа методом пьезометра постоянного объема. Воспроизводимость давления в системе по изохорам при нагреве и охлаждении составила 0.05%, что говорит об отсутствии заметного разложения молекул спирта.
R.J.B. Craven, K.M. de Reuck и W.A. Wakeham [77], анализируя работы, посвященные термическому разложению метилового спирта [78−80], приводят противоречивые данные по этому вопросу. Например они утверждают, что в работе [78] при проведении р, V, T — измерений метанола в диапазоне температур 298 — 623 К и давлений до 800 МПа обнаружено термическое разложение молекул спирта при температурах выше 523.15 К; в работе [79] упоминается о термической нестабильности метанола лишь при давлении ниже 0.16 МПа и при температуре 650 К и выше, а в работе [80] авторы указывают на термическую нестабильность молекул метанола уже при температуре 473 К и давлениях выше 4 МПа.
Thomas J. Bruno и Gerald C. Straty [81] при проведении р, V, T — измерений метилового спирта при температурах до 523.15 К методом пьезометра постоянного объема, обнаружили термическое разложение метанола уже при температуре 473.15 К. Хроматографический анализ газовой фракции показал пристутствие водорода и угарного газа. Масспектрометрический анализ жидкой фракции показал наличие формальдегида и диметилового эфира.
В работе [82] при проведении р, V, T — измерений этилового спирта в диапазоне температур 473.15 — 623.15 К и давлений 7 — 70 МПа методом пьезометра постоянного объема обнаружено термическое разложение молекул спирта. Исследуемый спирт выдерживался 10 — 15 минут при постоянной температуре опыта. Хроматографический анализ выдерженного при температуре 623.15 К спирта, показал наличие в системе 0.1% примесей, количество которых значительно возросло при температуре 653,15 К.
Straty G.C., Palavra A.M. и Bruno T.J. [83], исследуя р, V, T — свойства метанола методом пьезометра постоянного объема, обнаружили начало термического разложения спирта при Т=513.15 К по росту давления. Скорость разложения оценена по изменению давления в закрытой системе в единицу времени (ДР/Дф, Па/сек). Для этого спирт выдерживали в течение 50 часов при трех фиксированных значениях температуры и определенных значениях плотности (рис. 4).
В работе [84] при проведении р, V, T — измерений метанола методом пьезометра постоянного объема по изохорам и изотермам обнаружено термическое разложение молекул спирта в диапазоне температур 523.15−653.15 К. Начало процесса разложения оценивали по росту давления в системе при постоянной температуре опыта. Величину скорости протекания процесса при данной температуре опыта оценивали по величине роста давления за единицу времени (Р/). Установлено, что скорость термического разложения метанола увеличивается с ростом температуры. На рисунке 4 представлены изохоры зависимости давления от температуры соответственно при нагреве (точки) и охлаждении (сплошная линия). Хроматографический анализ продуктов разложения показал наличие формальдегида (5.16% масс.), диметилового эфира (1.19% масс) и газов (водород, метан).
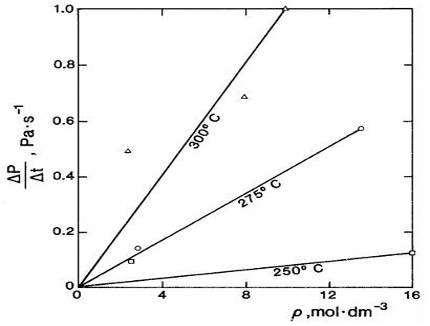
Рис. 4. Скорость термического разложения (ДР/Дф, Па/сек) метанола в зависимости от температуры опыта и плотности спирта
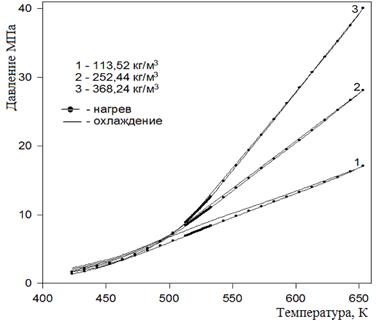
Рис. 5. Изохоры зависимости давления от температуры соответственно при нагреве (точки) и охлаждении (сплошная линия)
В работе [85] при исследовании р, V, T — свойств этанола методом пьезометра постоянного объема обнаружен небольшой рост давления при постоянной температуре опыта 623.15 К в течение 2 часов и значительный рост при температуре 673.15 К (ДР=3.5 МПа, Дф =5 часов). Авторы утверждают, что рост давления в системе связан с процессом термического разложения молекул этанола. На рисунке 6 изображена изохора зависимости давления от температуры для этанола при нагреве и охлаждении его в диапазоне 373.15 — 673.15 К, и выдержке при постоянной температуре 673.15 К в течение 5 часов.
![Изохора зависимости давления этанола 1- при нагреве 373.15 К....673.15 К, 2-при постоянной температуре 673.15 К (2) в течение 5 ч, 3-при охлаждении до 373.15 К [85].](/img/s/9/04/2309204_6.jpg)
Рис. 6. Изохора зависимости давления этанола 1- при нагреве 373.15 К…673.15 К, 2-при постоянной температуре 673.15 К (2) в течение 5 ч, 3-при охлаждении до 373.15 К [85].
Рис. 7 иллюстрирует рост давления на 9.2 МПа при той же температуре за 4 цикла нагрева от 523.15 К до 673.15 К и последующего охлаждения до комнатной температуры. В этой же работе [85] авторы, исследуя р, V, T — свойства водного раствора этилового спирта (0.5 мол. доли), не обнаружили термического разложния молекул спирта. Для выяснения влияния материала пьезометра на степень термического разложения молекул этанола авторы провели серию опытов с пьезометрами одинаковой конструкции и размеров, но изготовленными из трех разных сплавов ВТ3, ХН77ТЮРУ-ВД, 12Х18Н10Т. Ими сделан вывод, что материал практически не влияет на процесс разложения спирта.
Рис. 7. 1-изохора зависимости давления от температуры частично разложившегося этанола, 2−4-повторные измерения после охлаждения до комнатной температуры [85].