Адсорбция ПАВ на поверхностях раздела конденсированных фаз

Рис. III-5. Зависимости поверхностной концентрации х*я (кривые 1 и 2) относительной адсорбции ПАВ Г/Г^ (кривые 3и 4) на границе твердое тело — раствор от объемной концентрации х при сильной (кривые 1 и 3) и слабой (кривые 2 и 4) поверхностной активности адсорбирующегося компонента где ^" н К — молярные объемы ПАВ в поверхностном слое и объеме. При сильной поверхностной активности компонента… Читать ещё >
Адсорбция ПАВ на поверхностях раздела конденсированных фаз (реферат, курсовая, диплом, контрольная)
Рассмотрим кратко некоторые закономерности адсорбционных явлений на границах раздела двух конденсированных фаз при введении в систему третьего компонента, поверхностно-активного относительно этой межфазной поверхности.
П.А. Ребиндером сформулировано правило уравнивания полярностей, в соответствии с которым поверхностно-активным является компонент, способный скомпенсировать скачок полярностей, существующий на границе раздела двух разнородных фаз, состоящих из взаимно ограниченно растворимых (или практически нерастворимых) веществ.
Подобное уравнивание, или «сглаживание», разности полярностей в межфазной поверхности разрыва возможно, когда полярность третьего компонента оказывается промежуточной между полярностями двух других компонентов, образующих контактирующие фазы. Наиболее полное сглаживание полярностей происходит при адсорбции дифильных веществ, молекулы которых имеют резко различающиеся по полярности участки. Таковы органические ПАВ, способные скомпенсировать разность полярностей между водой и любой (жидкой или твердой) углеводородной фазой, обычно называемой для краткости «маслом». Молекулы ПАВ при этом ориентируются полярной группой в воду, а углеводородной цепью — в сторону «масла» (рис. Ill-1), создавая переходный слой, который (при достаточно высоких значениях адсорбции) в большой мере или даже практически полностью сглаживает разность полярностей между двумя фазами.

Рис. ИМ. Ориентация молекул ПАВ на межфазной границе вода — неполярная фаза (масло)
Именно на этом характерном примере адсорбции органических ПАВ на границе раздела масло — вода рассмотрим основные закономерности адсорбционных явлений на границе раздела конденсированных фаз в трехкомпонентных системах.
Взаимная растворимость воды и жидких или твердых углеводородов очень мала. В зависимости от способности растворяться в водной и масляной фазах, определяемой строением молекул, ПАВ делят на водои маслорастворимые, а также ПАВ промежуточной природы, растворимые как в водной, так и в масляной фазе. Водорастворимые ПАВ обычно несут заряженную полярную группу либо достаточно крупную полиоксиэтиленовую цепь и имеют углеводородный радикал умеренной длины (как правило, не более 16—18 атомов углерода). К маслорастворимым ПАВ относятся нерастворимые в воде вещества, которые образуют на границе раздела вода — воздух адсорбционные слои, исследуемые с помощью весов Ленгмюра. Эти ПАВ имеют одну или две (реже три) длинные углеводородные цепи и почти всегда слабо диссоциирующую или неионогенную полярную группу. Заметной растворимостью и в водной, и в масляной фазах обладают неионогенные ПАВ с небольшой длиной цепи, например низшие гомологи спиртов и кислот. В условиях равновесия эти ПАВ распределяются между водной и масляной фазами, причем при их низкой концентрации справедлив закон Генри:

где с" и см — концентрации ПАВ в водной и масляной фазах; К — коэффициент распределения.
При адсорбции водорастворимых ПАВ на границе раздела воды с жидким углеводородом наблюдаются закономерности, вполне аналогичные рассмотренным в гл. II для границы раствор — воздух. Здесь также справедливо правило Дюкло — Траубе, и концентрационная зависимость поверхностного натяжения может быть описана уравнением Шишковского (II.9). Более того, при одинаковой концентрации раствора понижения поверхностного натяжения на границах раздела вода — воздух и вода — углеводород обычно не очень сильно отличаются. Изотермы поверхностного натяжения для этих поверхностей идут симбатно (рис. III-2). Это связано с тем, что работа адсорбции (11.14) одной СНг-группы определяется в основном изменением стандартной части химического потенциала объемного раствора роКак и для границы раздела вода — воздух, энергетика адсорбции молекул ПАВ из водного раствора на поверхности вода — масло определяется гидрофобными взаимодействиями углеводородных цепей в объеме водного раствора, т. е. имеет энтропийную природу.

Рнс. III-2. Изотермы поверхностного натяжения водных растворов ПАВ на границе с воздухом (I) и межфазного натяжения на границе таких же растворов с гептаном (2).
Иная картина наблюдается при адсорбции на той же поверхности раздела фаз маслорастворимых ПАВ, растворенных в жидкой углеводородной фазе. В этих условиях увеличение длины цепи молекул ПАВ приводит лишь к слабому падению их поверхностной активности, что связано с небольшим увеличением растворимости ПАВ в углеводородной среде по мере увеличения длины цепи молекул. Энергетика адсорбции ПАВ из углеводородной среды на границе раздела вода — масло определяется гидратацией полярных групп при их выходе из углеводородной фазы на межфазную поверхность.
Все сказанное о природе адсорбции водои маслорастворимых ПАВ можно отнести и к ПАВ, растворимым в обеих фазах, по крайней мере при их небольших концентрациях. В этом случае в равновесии находятся растворы ПАВ в водной и масляной фазах и адсорбционный слой на межфазной поверхности. Применяя в области малых концентраций растворов уравнение Гиббса в приближенной форме к обеим фазам, можно записать.

Следовательно,.
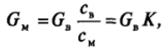
где (7В и Gu — значение поверхностных активностей при адсорбции из водной и масляной фаз. Коэффициент распределения К приближенно пропорционален отношению растворимостей ПАВ в водной и масляной фазах. Он (как и растворимость ПАВ в воде) падает в 3 — 3,5 раза с удлинением цепи молекул ПАВ на одну СН2-группу (растворимость в масляной фазе слабо изменяется с длиной цепи). Поскольку поверхностная активность ПАВ в водном растворе возрастает в то же число раз при переходе к каждому следующему гомологу, поверхностная активность ПАВ при адсорбции из масляной фазы, в соответствии со сказанным, слабо меняется с изменением длины цепи[1].
Существенные особенности обнаруживаются при высоком содержании в двухфазной системе ПАВ, растворимых и в водной, и в масляной фазах. Увеличение концентрации компонента с промежуточной полярностью в объемах обеих фаз приводит к снижению различия полярностей контактирующих фаз и вследствие этого к дополнительному (сверх чисто адсорбционных эффектов) понижению поверхностного натяжения межфазной поверхности до очень малых величин. Одновременно резко возрастает взаимная растворимость водной и масляной фаз и происходит сближение их составов вплоть до полного смешения (см. VI. 4). Снижение поверхностного натяжения поверхности раздела воды с углеводородом до очень малых значений может также происходить при введении мицеллообразующих ПАВ или смесей ПАВ, особенно водои маслорастворимых. Такая возможность понижения поверхностного натяжения до очень малых значений принципиально отличает границу раздела двух жидкостей от границы жидкость — воздух и тем более твердое тело — воздух, где и после достижения предельной адсорбции значения поверхностного натяжения остаются высокими.
Коэффициент распределения ПАВ между водной и масляной фазами является важной характеристикой соотношения родства к ним молекул ПАВ; однако, из-за малой растворимости большинства ПАВ в одной из фаз его экспериментальное определение достаточно затруднительно. Распространенной полуэмпирической характеристикой природы ПАВ является система гидрофильно-липофильного баланса (ГЛБ), введенная Гриффином и Дэвисом.
Значения ГЛБ для молекул ПАВ определяются по этой системе аддитивным сложением эмпирически найденных (в частности на основе изучения кинетики разрушения прямых и обратных эмульсий, см. гл. VIII. 3) так называемых групповых чисел В/ всех групп, составляющих молекулу: 
Значения групповых чисел ллА некоторых наиболее распространенных в молекулах ПАВ групп приведены в табл. III. 1; в табл. III.2 даны примеры рассчитанных таким способом значений ГЛБ некоторых ПАВ. Связь ГЛБ с коэффициентом распределения ПАВ между водной и углеводородной фазами определяется по Дэвису соотношением: 
Как показано Русановым [13], эмпирическая шкала ГЛБ получает термодинамическое обоснование при анализе работы переноса молекул ПАВ из водной в углеводородную фазу, при этом групповые числа В, пропорциональны работам переноса отдельных групп, а работа переноса молекулы есть результат аддитивного сложения работ переноса входящих в нее групп.
Таблица III.1. Значения групповых чисел для некоторых радикалов
Группа. | Групповое число. | Группа. | Групповое число. |
— S04Na. | 38,7. | — ОН. | 1,9. |
— COOK. | 21,1. | — О; | 1.3. |
— COONa. | 19,1. | — (С, н,0) ; | 0,33. |
sN. | 9,4. | — (С, н<0) ; | — 0,15. |
— соон. | 2,1. | — сн -, — сн2 — сн,. | — 0,475. |
Таблица III.2. Значения ГЛБ поверхностно-активных веществ, рассчитанные по групповым числам соответствующих радикалов
ПАВ | ГЛБ | ПАВ | ГЛБ |
Л аур ил сульфат натрия | Бутанол | 7.0 | |
Олеат калия | Моностеарат глицерина | 3,8 | |
Олеат натрия | Олеиновая кислота | -LQ | |
CuH"N (C, H4OH)(C, H4OC, H4OH). |
Перейдем к рассмотрению некоторых закономерностей адсорбции из раствора ПАВ на поверхности твердого тела. Прежде всего отметим, что основным, наиболее простым и широко распространенным методом изучения адсорбционных явлений в подобных системах является исследование концентрационной зависимости адсорбции ПАВ. Для этого обычно используются твердые тела с большой удельной поверхностью — порошки или тонкопористые адсорбенты. Если удельная поверхность адсорбента S неизвестна, определяется общее количество вещества Г*, поглощенного единицей массы адсорбента, выражаемое обычно в молях на грамм адсорбента. Эту величину, также называемую адсорбцией, можно найти по убыли концентрации адсорбирующегося вещества Ас в определенном объеме V раствора после достижения адсорбционного равновесия: 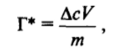
где т — масса адсорбента.
Если удельная поверхность адсорбента 5| известна (обычно из экспериментов по адсорбции газов), то можно определить адсорбцию ПАВ на единицу поверхности адсорбента Г = Г*/S. Изучение концентрационной зависимости адсорбции Г и Г* позволяет получить сведения о строении поверхности и адсорбционных слоев.
В соответствии с правилом уравнивания полярностей наибольшей способностью к адсорбции и в этих случаях обладают вещества с полярностью, имеющей промежуточные значения между полярностями контактирующих фаз. Так, на поверхности раздела между водным раствором органического ПАВ и неполярным твердым телом (парафин, сажа, уголь, в том числе активированный уголь с большой удельной поверхностью) образуются адсорбционные слои, в которых углеводородные цепи ориентированы к поверхности твердой фазы, а полярные группы находятся в воде (рис. III-3, а). В этом состоит, в частности, один из главных факторов, обусловливающих моющее действие ПАВ (см. VIII.6).
Наоборот, при погружении полярных твердых тел или порошков (оксидов, карбонатов, силикатов и алюмосиликатов, например мела, глин и др.) в масляную фазу, содержащую маслорастворимое ПАВ, происходит образование адсорбционных слоев, в которых полярные группы расположены на поверхности твердой фазы, а углеводородные.

Рис. Ш-З. Ориентация молекул ПАВ на различных межфазных границах:
а — неполярное твердое тело — водный раствор ПАВ; б — полярное твердое тело — раствор ПАВ в неполярной жидкости (масло) цепи «плавают» в масляной среде (рис. Ш-З, б). Этот процесс имеет принципиальное значение при введении полярных наполнителей и пигментов в углеводородную или малополярную полимерную фазу.
При достаточной концентрации ПАВ в растворе в обоих случаях образуются плотные адсорбционные слои, которые могут радикально менять свойства поверхностей (см. с. 132).
Существенной особенностью поверхности раздела твердое тело — жидкость является то, что адсорбирующееся вещество может связываться с поверхностью не только слабыми «физическими силами», но и за счет образования химических связей с молекулами (ионами), расположенными на поверхности твердой фазы. Это явление, называемое хемосорбцией, может приводить к кажущемуся несоблюдению правила уравнивания полярностей: на границе раздела полярного кристалла (например, силиката или сульфида) и полярной среды (воды) адсорбция происходит таким образом, что углеводородные радикалы оказываются обращенными в сторону воды (рис. III-4, а). При достаточно высоких концентрациях хемосорбирующегося ПАВ, когда уже вся поверхность покрыта монослоем, начинается образование противоположно ориентированного второго слоя, т. е. «обычная».
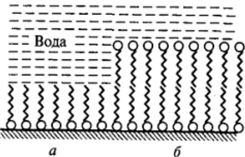
Рис. III-4. Ориентация молекул ПАВ на межфазной границе полярное твердое тело — водный раствор в условиях хемосорбции при малых (д) и больших (б) концентрациях ПАВ в объеме.
адсорбция ПАВ из водного раствора на неполярной поверхности (рис. III-4, б). Способность хемосорбирующихся ПАВ при адсорбции из водного раствора образовывать на поверхности частиц полярной твердой фазы адсорбционные слои с направленными в водную фазу углеводородными цепями («намасливать» частицы) лежит в основе применения ПАВ для управления процессом флотационного обогащения полезных ископаемых (см. с. 136).
При изучении адсорбционных явлений на границе раздела раствор ПАВ — твердое тело ярко проявляются особенности изотерм адсорбции в области высоких концентраций ПАВ. Рассмотрим форму изотермы адсорбции из раствора на поверхности твердого адсорбента в системе с неограниченно смешивающимися компонентами раствора во всей области концентраций ПАВ от мольной доли х, равной 0, до 1; для этого сопоставим концентрации ПАВ в поверхности У" и в объеме х.
В нерасслаивающихся системах возрастанию объемной концентрации х отвечает и рост поверхностной концентрации Xм. В зависимости от природы ПАВ и межфазной поверхности раздела возможны два вида зависимости х**(х) (рис. III-5). При сильной поверхностной активности адсорбирующегося компонента наблюдается (кривая I) резкий рост х"* вплоть до полного насыщения поверхностного слоя (У = 1) в области малых объемных концентраций х. При слабой поверхностной активности зависимость xfx) может иметь S-образную форму (кривая 2). В точке пересечения Л составы поверхностного слоя и объема раствора одинаковы — наблюдается своеобразная «поверхностная азеотропия» раствора.

Различному характеру зависимости Xм* (х) отвечает и различный вид изотерм адсорбции Г (х). Адсорбция может быть выражена через избыток концентрации в поверхностном слое и толщину этого слоя 8 с помощью соотношения (II.2):
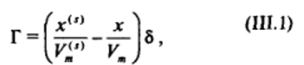
Рис. III-5. Зависимости поверхностной концентрации х*я (кривые 1 и 2) относительной адсорбции ПАВ Г/Г^ (кривые 3и 4) на границе твердое тело — раствор от объемной концентрации х при сильной (кривые 1 и 3) и слабой (кривые 2 и 4) поверхностной активности адсорбирующегося компонента где ^" н К — молярные объемы ПАВ в поверхностном слое и объеме. При сильной поверхностной активности компонента (первый вид зависимости х‘я(х)) во всей области значений объемной концентрации ПАВ (вплоть до х = 1) поверхностная концентрация превышает объемную (т. е. х" 9 >х). В таком случае на изотерме адсорбции Г (х) имеется максимум (кривая J). При этом в области значительных поверхностных концентраций х1", приближающихся к единице, адсорбция Г практически линейно уменьшается с ростом концентрации раствора х. Экстраполяция этого линейного участка изотермы адсорбции Г (х) на нулевую концентрацию в объеме (х = 0), согласно выражению (III.1), дает значение предельной адсорбции Гм * Ь/V™. На рис. I1I-5 этому отвечает значение Г/Г *= 1 при х->0.
Второму типу зависимости У" (х) (в форме S-образной кривой) отвечает изотерма адсорбции, имеющая максимум и минимум, расположенный в области отрицательных значений Г (кривая 4). Точке поверхностной азсотропии соответствует, естественно, нулевое значение адсорбции.
Следует отметить, что в таких системах оба компонента являются поверхностно-активными в области малых концентраций и инактивными в области высоких концентраций. Подобный вид зависимости адсорбции от концентрации наблюдается для растворов, находящихся невдалеке от точки расслаивания.
Еще одна особенность адсорбции из растворов на поверхности твердых тел заключается в том, что заметную роль в адсорбционных и, в первую очередь, хемосорбционных процессах может играть неоднородность (мозаичность) строения поверхности и особенно различные дефекты структуры поверхности. Это имеет важное значение при хемосорбции на поверхности полярных тел неорганических ионов, создающих заряд поверхности.
Адсорбция из растворов на границе между двумя жидкостями и жидкости с твердым адсорбентом имеет важное практическое значение в самых различных областях техники, природных процессах и широко используется в лабораторной практике. Многие вопросы, связанные с управлением свойствами дисперсных систем с помощью адсорбционных слоев, рассматриваются в последующих главах; здесь ограничимся лишь некоторыми характерными примерами практического использования явлений адсорбции из растворов на твердых адсорбентах.
Это прежде всего применение адсорбции из растворов на высокодисперсных порошках и пористых адсорбентах для очистки различных растворов от вредных примесей либо для улавливания и концентрирования ценных веществ из разбавленных растворов. В соответствии с правилом уравнивания полярностей поверхностно-активные примеси, растворенные в водной среде, могут быть удалены из нее с помощью неполярных адсорбентов (обычно активированного угля) или же адсорбентов, на которых может происходить хемосорбция полярных групп молекул ПАВ. Чтобы повысить эффективность очистки стоков от растворенных ПАВ, часто используют высокодисперсные системы, возникающие при выпадении новой фазы из пересыщенного раствора (см. VI.5). Аналогичным способом могут быть извлечены и электролиты (см. III. 3). При очистке от примесей маслорастворимых ПАВ неполярных сред (например, для повышения «электрической прочности» трансформаторных масел) используют полярные адсорбенты, в частности высокодисперсные глины и цеолиты.
Адсорбция из жидкостей на твердых адсорбентах лежит в основе аналитических и препаративных методов жидкостной адсорбционной хроматографии, рассматриваемых подробно в курсе физической химии. В адсорбционной хроматографии используют отличия в средних временах жизни в адсорбированном состоянии компонентов раствора, т. е. кинетику процесса. Среднее время пребывания молекул вещества в адсорбционном слое /а определяется его энергией адсорбции ро — j4s):

Эта энергия, как было показано в гл. II. 2, может быть найдена из отношения концентраций компонента на поверхности и в объеме:
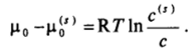
Таким образом,.
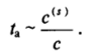
Многократное повторение актов адсорбции и десорбции при течении раствора через слой адсорбента приводит к «отставанию» наиболее поверхностно-активных компонентов, что позволяет определить их содержание в исходном растворе или отделить их от других, менее адсорбционно-активных веществ. Методы адсорбционной хроматографии широко применяют для фракционирования аминокислот, нуклеиновых кислот, белков и других биополимеров, для выделения различных ферментов и лекарственных препаратов (пенициллина, тетрациклина, алкалоидов и др.).
Адсорбцию из растворов часто используют и как сравнительно простой в аппаратурном оформлении метод определения удельной поверхности адсорбентов. При этом измеряется убыль концентрации молекул ПАВ Дс в некотором объеме У раствора после достижения равновесия раствора над известной навеской адсорбента т и рассчитывается изотерма адсорбции Г*©. По уравнению Ленгмюра, например из зависимости с/Г* = а/Г*тах + с/Г*тах (см. II. 2), определяют предельную адсорбцию Г*тах, моль/r. Используя независимые данные о посадочной площадке $i молекул ПАВ на аналогичном порошке, можно найти удельную поверхность адсорбента S, м2/г:
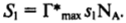
Адсорбцию на границах раздела конденсированных фаз широко используют для управления процессами смачивания.
В заключение кратко остановимся на адсорбционных явлениях на границах зерен поликристаллических тел. Как и при адсорбции на других межфазных поверхностях, термодинамическое описание адсорбции на границах зерен основывается на уравнении Гиббса. Здесь также поверхностно-активными являются вещества, которые снижают свободную энергию границы зерна, и эти вещества самопроизвольно концентрируются на такой границе (этот процесс иногда называют сегрегацией примесей на границах зерен). Вместе с тем при адсорбции на границах зерен существует и ряд особенностей.
Прежде всего необходимо отметить, что адсорбционные процессы в твердых телах, как правило, реализуются в неравновесных условиях: из-за малой скорости диффузионных процессов равновесие между объемом зерен и их границами устанавливается крайне медленно. Другой особенностью адсорбции на границах зерен в реальных поликристаллических телах является широкий спектр значений энергий адсорбции примеси. Это связано как с резким отличием энергий границ по-разному ориентированных зерен (см. I. 2), так и с неоднородностью самих границ, т. е. с наличием «дефектных» участков с неодинаковой плотностью энергии и даже пустот разного размера. При этом для адсорбции примесей на границах зерен характерна значительная избирательность. Одной из ее причин является преимущественная адсорбция компонентов, размеры атомов которых отвечают размерам наиболее типичных дефектов, существующих на границах зерен.
Адсорбция примесей на границах зерен поликристаллических материалов может вызвать резкое изменение их свойств, и прежде всего механических (с этим, в частности, связана так называемая красноломкость сталей, которая вызывается адсорбцией серы, а также меди на границах зерен). Для защиты от этих вредных явлений необходима очистка материала от опасных примесей; возможен также иной, адсорбционный путь — введение более поверхностно-активных добавок, не вызывающих подобных эффектов, но способных вытеснить вредные примеси с границ зерен (либо добавок, связывающих такие примеси).
- [1] См.: Абрам зон А.А. Поверхностно-активные вещества, свойства и применение.Л.: Химия, 1981.