Диаграммы состояния двойных систем

Из правила фаз следует, что вариантность любой системы всегда положительна или равна нулю, т. е. DO. При С = О система называется нонвариантной. Это значит, что все независимые переменные, определяющие ее состояние, имеют строго фиксированные (единственные) значения, которые нельзя изменять, чтобы не нарушить фазовое равновесие в системе, т. е. нс изменить число равновесных фаз. При С = 1 систему… Читать ещё >
Диаграммы состояния двойных систем (реферат, курсовая, диплом, контрольная)
Основные понятия. Материальная система, состоящая из одной или нескольких частей, — это часть пространства, выделенная для какого-либо исследования из внешней среды. Если эти части обмениваются энергией, такую систему называют термодинамической, если возможен обмен не только энергией, но и веществом — физико-химической.
В зависимости от характера связи системы с внешней средой различают изолированные, закрытые и открытые системы. Изолированные системы не обмениваются с окружающей средой ни энергией, ни веществом; закрытые системы обмениваются с окружающей средой только энергией; открытые системы — энергией и веществом.
Физико-химические системы, которые можно получить при сплавлении двух или большего числа металлов и неметаллов (например, системы Fe — С, А1 — Си — Mg, Mg — Al — Zn — Mn идр.), обычно относятся к закрытым или открытым. Пример закрытой системы — металл или сплав в запаянной ампуле, изготовленной из материала, который не взаимодействует с ее содержимым, заполненной инертным газом или с вакуумом; пример открытой системы — металл или сплав, взаимодействующий с окружающей средой (например, печной атмосферой).
Металлические системы могут состоять из одной фазы (гомогенные системы) или нескольких фаз (гетерогенные системы). Любая гомогенная система всегда однофазна и ее химический состав идентичен составу фазы. Гетерогенная система, напротив, всегда многофазна и ее фазы могут находиться в различных агрегатных состояниях (твердом, жидком или газообразном), иметь как одинаковый, так и разные составы. Например, расплав и кристаллы чистого металла — это две разные фазы одного химического состава, а кристаллы твердого раствора на основе металла и химического соединения — это две фазы разного состава.
Химический состав каждой фазы в металлическом сплаве определяется концентрациями компонентов, которые являются чистыми металлами, неметаллами или химическими соединениями. Число компонентов не обязательно равно общему числу отдельных веществ, способных образовывать систему. Например, сплав А1 + 5% Mg2Si при комнатной температуре состоит из двух фаз — твердого раствора магния и кремния в алюминии и соединения Mg2Si, но он не четырехкомпонентный (Al, Mg, Si и Mg2Si), так как для образования его фаз достаточно алюминия и соединения Mg2Si, т. е. всего двух компонентов.
В зависимости от различных факторов равновесия (температура, давление и концентрация компонентов) в разных фазах — физико-химическая система может находиться в различных состояниях. В стабильной системе все факторы равновесия во всех фазах имеют одинаковые значения, не изменяющиеся во времени. В метастабильной системе факторы равновесия также могут иметь одинаковые значения во всех фазах, но они могут изменяться во времени, в результате чего энергия Гиббса G (изобарный потенциал, одна из характеристических функций термодинамической системы) будет уменьшаться, и система приближается к стабильному состоянию с более низкой энергией. При переходе системы из одного состояния в другое в результате фазовых превращений появляются новые или исчезают исходные фазы.
Существование метастабильных состояний связано с особенностями кинетики фазовых превращений. Для образования новой стабильной фазы обычно требуется возникновение ее зародышей и их последующий рост, а это в ряде случаев может оказаться невозможным, поэтому фазовое превращение задерживается во времени, и система оказывается в метастабилыюм состоянии.
Правило фаз. Возможность изменения состояния системы (т.е. химического состава фаз и их числа) определяется ее вариантностью или числом степеней свободы — числом независимых один от другого факторов равновесия, которые в определенных пределах можно изменять произвольно, но при этом фазовое состояние системы не нарушается — в ней не появляются новые или исчезают исходные фазы.
Связь между числами компонентов ку равновесных фаз/, температурой Г, давлением Р и вариантностью С (или числом степеней свободы) любой равновесной системы устанавливает правило фаз Гиббса (1876):
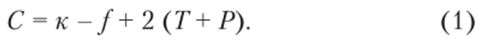
При исследовании металлических систем, находящихся в конденсированном (жидком или твердом) состоянии, постоянным считают внешнее давление Р, так как изменение давления в пределах даже нескольких мегапаскалей не оказывает существенного влияния на изменение состояния жидких и твердых сплавов. Поэтому для анализа фазовых равновесий в таких системах правило фаз записывают как:

Влиянием давления нельзя пренебрегать в тех случаях, когда один из компонентов обладает повышенной упругостью пара или в обычных условиях находится в газообразном состоянии, т. е. при анализе фазовых равновесий в системах металл — летучий компонент или металл — газ. Примерами таких систем могут служить Ni—S, Ti—Н, Fe—N и др.
Из правила фаз следует, что вариантность любой системы всегда положительна или равна нулю, т. е. DO. При С = О система называется нонвариантной. Это значит, что все независимые переменные, определяющие ее состояние, имеют строго фиксированные (единственные) значения, которые нельзя изменять, чтобы не нарушить фазовое равновесие в системе, т. е. нс изменить число равновесных фаз. При С = 1 систему называют моновариантной, при С = 2 — бивариантной и т. д. Наличие одной, двух или большего числа степеней свободы позволяет независимо изменять соответственно одну, две или большее число переменных без изменения числа фаз в системе, т. е. не нарушая того или иного фазового равновесия.