Квантовая теория водородоподобного атома

Расчет по этой формуле подтвердил измерения Бальмера и предсказал спектральные серии атома водорода, обнаруженные затем Т. Лайманом, Ф. Пашеном и другими спектроскопистами (см. рис. 9.8). Это был настоящий триумф Н. Бора (1885—1962, Нобелевская премия 1922 г.). Для проверки его теории немецкие физики Д. Франк и Г. Герц провели эксперименты с парами ртути и другими газами. В трубке, наполненной… Читать ещё >
Квантовая теория водородоподобного атома (реферат, курсовая, диплом, контрольная)
Квантовый характер электромагнитного излучения в виде наборов отдельных частот был известен и до появления квантовой механики. Линейчатые спектры излучения атомарных газов были даже систематизированы. Например, швейцарский физик И. Бальмер (1825—1898) нашел эмпирическую формулу для спектра атома водорода (серия Бальмера, 1885 г., рис. 9.8).
Очевидно, что особенности излучения следует искать в его источнике, т. е. в атоме вещества. О том, что атом нельзя считать неделимым, т. е. он имеет внутреннюю структуру, свидетельствовало открытие рентгеновских лучей, электрона, радиоактивности и особенно — эксперименты 1911 г. британского физика (родом из Новой Зеландии) Э. Резерфорда (1871 — 1937). Последние опровергли модель Дж. Дж. Томсона 1903 г., полагавшего, что атом представляет собой сплошную положительно заряженную сферу с вкрапленными в нее электронами (словно булка с изюмом). Резерфорд убедительно доказал, что атом в основном пуст, а весь его положительный заряд и (в основном) масса сосредоточены в ядре размером ~10 15 м. Нобе;
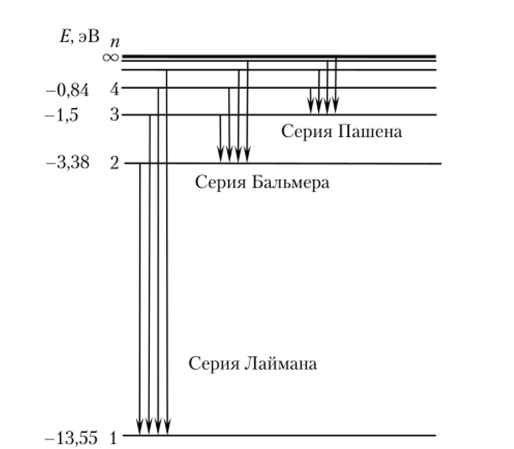
Рис. 9.8.
левская премия была присуждена Резерфорду до этого (1908 г.), но в результате названных, весьма значимых опытов он стал президентом Лондонского королевского общества (аналог академии паук). Тем не менее модель Резерфорда оказалась внутренне противоречивой.
Во-первых, его атом неустойчив: притягиваясь к ядру, электроны должны были бы на него упасть. Резерфорд предположил, что этому препятствует их вращение по орбитам, при котором центробежная сила компенсирует кулоновскую — центростремительную. Такая планетарная модель атома напоминает Солнечную систему (первым, хотя и без обоснования, ее предложил немецкий физик В. Вебер еще в 1871 г.!). Однако и эта модель ситуацию не спасает. В соответствии с законами электродинамики электроны, движущиеся с центростремительным ускорением, обязаны излучать электромагнитные волны. В результате они должны терять энергию и все-таки упасть на ядро (то же происходит со спутником Земли вследствие потерь энергии на трение о воздух).
Во-вторых, излучение атомов в их нормальном состоянии не наблюдается вообще. Из этого следует, что электроны по орбитам не движутся.
В-третьих, если излучение атомарного газа и возникает, то выглядит оно вовсе не так, как это следовало бы из планетарной модели. Плавное уменьшение радиуса орбиты должно было бы привести к монотонному увеличению частоты излучения, т. е. к сплошному спектру, а наблюдаемый спектр — линейчатый.
Для снятия всех этих противоречий выдающийся датский физик Н. Бор в 1913 г. также привлек квантовую теорию (идея пришла к нему во сне). Чтобы совместить ее с успехом Резерфорда, он выдвинул несколько постулатов:
- • в атоме существуют стационарные состояния (орбиты), находясь в которых, он не излучает энергию;
- • при переходе атома из одного стационарного состояния в другое происходит испускание или поглощение атомом кванта электромагнитного поля:

где Eri, Ет — энергии атома в двух стационарных состояниях (на равных орбитах электрона); v — частота излучения при переходе электрона с орбиты на орбиту. Если Еп > Ет, то происходит излучение фотона, если Еп < Ет, то поглощение фотона с такой же энергией.
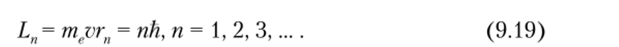
Еще один постулат относился к моменту импульса электрона, находящегося на стационарных орбитах. Впоследствии оказалось, что на них укладывается целое число открытых позже волн де Бройля: 2nrn/X = п, п = 1, 2, 3,… Совместно с формулой (9.9) это приводит к квантованию момента импульса электрона:
Поскольку полная энергия электрона (сумма кинетической и потенциальной энергий) Е = mev2/2 — е2/(4пе0гп), а центростремительная кулоновская сила e2/(4n?0r2) = mev2/rn, то отсюда радиусы орбит и соответствующие им энергии равны.

тее'.
8/??q/22 '.
Подставляя постоянные, найдем для первой орбиты атома водорода г{ ~ — 0,5*10 10 м, что совпало с молекулярно-кинетическими и резерфордовскими оценками! В то же время формула (9.20) определяет совокупность тех энергетических уровней атома, на которых он может находиться (см. рис. 9.8). Как очевидно из рис. 9.8, с ростом п они все ближе друг к другу, т. е. АЕ все меньше.
При п —? °о Еп = 0, что соответствует высвобождению электрона из атома (внутри атома Еп < 0). Самый низкий уровень энергии называется основным, или нормальным, состоянием (уровнем). Именно в этом состоянии атом обычно и находится. Более высокие энергетические состояния (уровни) называются возбужденными — они возникают в результате поглощения энергии удара, кванта излучения и т. д. В таком состоянии атом долго находиться не может и самопроизвольно (или, как говорят, спонтанно) возвращается в основное состояние, излучая квант энергии.
Возможные частоты излучения следуют из формул (9.18) и (9.20):
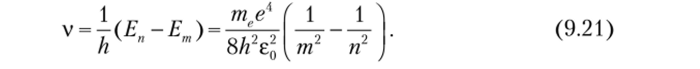
Расчет по этой формуле подтвердил измерения Бальмера и предсказал спектральные серии атома водорода, обнаруженные затем Т. Лайманом, Ф. Пашеном и другими спектроскопистами (см. рис. 9.8). Это был настоящий триумф Н. Бора (1885—1962, Нобелевская премия 1922 г.). Для проверки его теории немецкие физики Д. Франк и Г. Герц провели эксперименты с парами ртути и другими газами. В трубке, наполненной ртутью при давлении ~1 мм рт. ст., из раскаленного катода К вылетают электроны и ускоряются напряжением U к сетчатому электроду С (рис. 9.9, а). По пути они сталкиваются с атомами ртути. Часть электронов оседает на сетке, а часть, пролетев сквозь ее отверстия, попадает в слабое тормозящее поле между сеткой С и анодом, А (фс — фА «0,5 В).
Электроны, попавшие на анод, создают ток /, измеряемый гальванометром. Зависимость I (U) показана на рис. 9.9, б.
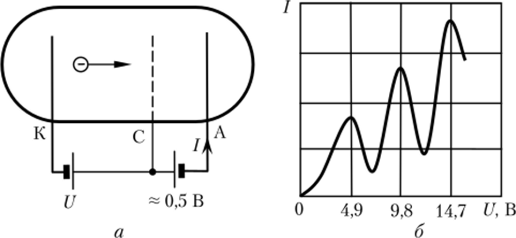
Рис. 9.9.
ВОПРОС. Чем объяснить волнистость зависимости /((/)?
ОТВЕТ. При U < 4,9 эВ энергии свободных электронов недостаточно для возбуждения атома ртути, и поэтому они сталкиваются с атомами упруго, практически нс теряя своей энергии (так как масса электрона много меньше массы атома). Чем больше U, тем больше энергия электронов, достигших сетки С. Соответственно, большее их количество преодолевает тормозящее поле между С и А, поэтому ток / растет. При U > 4,9 В многие электроны уже способны своими ударами возбудить атомы, теряют энергию на неупругие удары и уже не могут преодолеть тормозящее ноле, и ток уменьшается.
Если это предположение верно, то при спонтанном возврате в основное состояние возбужденные атомы должны излучать свет! И действительно, в ультрафиолетовой области было обнаружено излучение ртути именно с таким /zv, которое соответствует энергии 4,9 эВ. Тем самым Франк и Герц убедительно подтвердили модель Бора, за что получили Нобелевскую премию (1925 г.).
И все же количественные результаты теории Бора оказались верны только для водорода и водородоподобных ионов (у которых остался один электрон). Более того, даже успех с водородом впоследствии показался странным. Дело в том, что при всех своих несомненных достоинствах теория Бора внутренне противоречива} поскольку совмещает несовместимое — квантовые скачки с представлениями классической физики о траекториях (орбитах). Атом — это слишком маленький объект (~10 10 м), в котором о точных координатах говорить уже нельзя. Поэтому, несмотря на то что теория Бора сыграла огромную роль в становлении современной физики, а ее представления об энергетических уровнях актуальны и поныне, для количественных расчетов следует все же пользоваться уравнением Шредингера.