Расчет изоморфной емкости матриц хлорид-бромида серебра

Для наших целей наиболее подходящей является система расчета, предложенная Бацановым и основанная на шкале электроотрицательностей Полинга, поскольку она позволяет рассчитать несуществующие в природе гипотетические связи. Уже проведен такой расчет для Agl со структурой NaCl (Е = 0,62). Тот же расчет, выполненный нами, исходя из несколько других значений электроотрицательности галогенид-ионов, дал… Читать ещё >
Расчет изоморфной емкости матриц хлорид-бромида серебра (реферат, курсовая, диплом, контрольная)
Полученные результаты по экспериментальному определению растворимости йодида серебра в твердых растворах AgCl, В г было интересно сопоставить с теоретическими расчетами изоморфной емкости (? ТР, %) этих матриц по энергетической теории изоморфной смесимости В. С. Урусова [8]. В соответствии с положениями этой теории вывод о растворимости соединений можно сделать на основе расчета энтальпии смешения (АН), которая позволяет определять максимальную температуру распада (Г) твердых растворов по формуле (2.2):

где х, и х2 — мольные доли замещающихся компонентов состава, для которого рассчитана ДЯ ц. В свою очередь, энтальпию смешения при образовании твердых растворов замещения находят расчетным путем, исходя из различий в размерных характеристиках (ДR/R), степенях ионносги (Де) химических связей двух соединений и ряда других [7], если соединения изоструктурны. В конечном счете уравнение расчета АНс приобретает следующий вид:
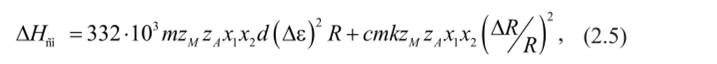
где с — константа, равная 30 000 кал/моль; т — сумма ионов и катионов MwA, составляющих соединение МА для AgHal т = 1 + 1 = 2. Координационное число (К = 6), z, ia — формальные валентности ионов М и А; а — константа Маделунга, равная для структуры NaCl 1,7; Дг — разница в степенях ионности двух соединений, AR/R — относительная разница межатомных расстояний Ag-Hal. Таким образом, уравнение для расчета Тмм приобретает следующий вид:
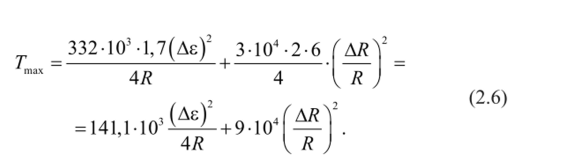
Поскольку речь идет об изоморфной емкости, то вместо среднего значения межатомного расстояния можно использовать R для матрицы и тем самым, сделав его постоянным членом уравнения, уравнение (2.6) преобразуется в двучленное уравнение:
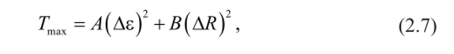
значения А и В для которого приведены в табл. 2.6. Таким образом, при возрастании Т, т. е. уменьшении растворимости двух соединений, происходит с увеличением различий в характере химических связей и приувеличении размерных отличий. Но существует и третий фактор, который уменьшает вероятность образования твердых растворов замещения — неизоструктурность взаимодействующих веществ. Показано, что при неизоструктурности или диморфизме одного из участников двойной системы в уравнении при расчете Гмах необходимо учитывать и теплоту полиморфного превращения соединения-примеси (ДП) в структуре матрицы [11]:
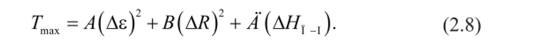
Последнее утверждение не всегда возможно определить из-за отсутствия прямых экспериментальных определений или вследствие того, что растворимое соединение не кристаллизуется в данном типе структуры. В частности, это относится и к йодиду серебра, который при обычных давлениях существует в отличных от других галогенидов серебра типах структуры.
Следовательно, для решения поставленной задачи необходимо найти характеристики (энергетические и размерные) гипотетического йодида серебра со структурой поваренной соли, что позволит свести ее к расчетам по двучленному уравнению (2.7), либо рассчитать соответствующие энтальпии перехода различных модификаций йодида серебра. В настоящей работе выбран первый путь.
Известно, что многие свойства изоструктурных соединений линейно изменяются в зависимости от характеристик слагающих их ионов. Для ряда галогенидов серебра переменной составляющей являются анионы галогенов: F, СГ, Вг и Г. Первые три члена ряда изоструктурны между собой [5]. Можно было предположить, что межатомные расстояния Ag — Hal линейно изменяются от изменения размеров аниона. Действительно, такая закономерность наблюдается в рядах щелочноземельных галогенидов и серебра. На рис. 2.15, а, представлены зависимости изменения расстояний катион-анион для галогенидов калия, рубидия, натрия и серебра в зависимости от классических размеров ионных радиусов анионов [5]. Экстраполяция зависимости для галогенидов серебра на йодид-ион дает значение для /?(Ag-I), равное 3,03−3,04 А, Это хорошо согласуется со значением, приводимым Банановым [10] для расстояния Ag -1 при К = 6, равное 3,04 А. Это значение и принято для дальнейших расчетов.
Наиболее сложным является вопрос о расчете степени ионности связи анион-катион, поскольку существуют как различные экспериментальные методы ее определения, так и различные системы расчета, которые по данным не всегда достаточно точны. Однако положение облегчается тем, что при определении Гтах используются не абсолютные значения, а разностные характеристики степеней ионности связи. Поэтому ошибка уменьшается при использовании какой-то одной системы расчета или определения.
Для наших целей наиболее подходящей является система расчета, предложенная Бацановым [10] и основанная на шкале электроотрицательностей Полинга, поскольку она позволяет рассчитать несуществующие в природе гипотетические связи. Уже проведен такой расчет для Agl со структурой NaCl (Е = 0,62) [9]. Тот же расчет, выполненный нами, исходя из несколько других значений электроотрицательности галогенид-ионов [10], дал значение 0,58. Но далее использовались данные Бацанова.
![Зависимость расстояний катион-анион (Л) для различных галогенидов металлов (а) и зависимость степени ионности (е, %) галогенидовсеребра от радиуса галогенид-иона (б) [5, 11].](/img/s/8/07/1447607_6.png)
Рис. 2.15. Зависимость расстояний катион-анион (Лм ш) для различных галогенидов металлов (а) и зависимость степени ионности (е, %) галогенидовсеребра от радиуса галогенид-иона (б) [5, 11].
Значения для хлорид-бромида серебра найдены из графика, приведенного на рис. 2.16, в предположении аддитивности (s) смешанных галогенидов, как и у индивидуальных галогенидов серебра (рис. 2.15, б).
Ниже приведены результаты расчета изоморфной емкости чистых бромида и хлорида серебра и двух хлорид-бромидных матриц, одна из которых представляет поликристаллическую матрицу AgCl025Br075.
Полученные значения Т могут быть использованы для расчета границ твердых растворов при различных температурах и последующего сопоставления с экспериментальными данными. Расчет ведут по специальным номограммам, приведенным в справочнике химика [13] и построенным в рамках теории регулярных растворов. В табл. 2.7 приведены значения изоморфной емкости (LTP, мол. %) для температуры тройной эвтектики (573 К) и комнатной температуры (298 К).
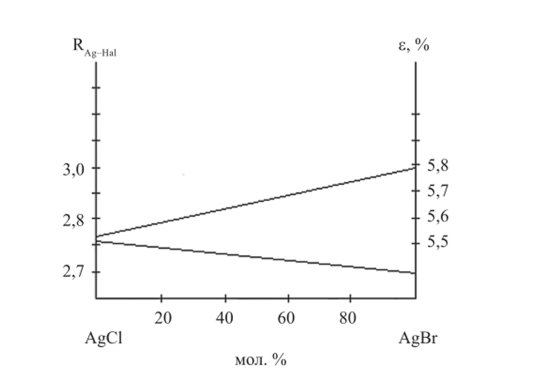
Рис. 2.16. Зависимости расстояния Ag — Hal и степени ионности связи Ag — Hal в системе AgCl — AgBr.
Таблица 2.6
Максимальные температуры распада твердых растворов галогенидов серебра
Матрица. | Л.. А. Ag-r*. | А, К. | В, А 2 | Г, к. | г2, к. | гах, К. | |
AgBr. | 2,88. | 0,65. | 490 • 10! | О. '^1. О. | |||
АёВГ0.69С10.3 | 2,86. | 0,66. | 497 • 102 | 1,11 • 104 | |||
АёВГО.23С10.77. | 2,80. | 0,67. | С/|. О СЛ О. | 1,15 • 104 | |||
AgCl. | 2,77. | 0,68. | 509 • 102 | 1,17 • 104 |
Как следует из табл. 2.7, бромид серебра и эвтектичесий состав системы AgCl — AgBr должны при 300 °C растворять более 50 мол. % Agl и, вероятно, образовывать неограниченные твердые растворы. Однако реальная растворимость при этой температуре достигает 20−23 мол. %. В то же время, по крайней мере для двойной системы AgBr-AgI, поля твердых растворов на основе AgBr и a-Agl почти сливаются при температуре двойной эвтектики 369 °C.
Таблица 2.7
Изоморфная емкость (мол. %) хлорид-бромида серебра, но отношению к йодиду серебра
Матрица. | га>> К. | Т/Ттзх | ТР, мол. %. | |
теор. | экспл. | |||
AgBr. | 1,08. | |||
А8ВГ0.бЯо.> | 0,95. | |||
AgBl0.75CI0.77. | 1,40. | |||
AgCl. | 0,70. | |||
0,70. | 8−10. | ; | ||
0,37. | ; | |||
0,55. | 3−4. | 10−12. | ||
0,30. | 5−6. | |||
Это можно считать хорошим приближением расчета к реальным фазовым отношениям с учетом выбранной модели. С увеличением в составе матрицы доли ионов хлора растворимость йодида серебра уменьшается, вследствие увеличения ДR/R и возрастания различий в степенях ионности связей. В общем, расчетные значения ТР достаточно верно предают характер изменения растворимости, хотя в свете устойчивости монокристаллов системы AgCl-AgBr выращиваемых из такого рода матриц, необходимо провести дальнейшее изучение границ существования твердых растворов, получаемых при температурах не выше 50 °C. Кроме того, необходимо исключить неоднородность образцов, полученных в результате плавления и влияния закалки равновесных высокотемпературных состояний.