Общие принципы анализа и расчета процессов и аппаратов

Закон кратных отношений состоит в том, что при образовании какого-либо простого или сложного вещества элементы в молекуле последнего входят в количествах, равных или кратных их атомному весу. Если же отнести этот закон к объемам, вступающих в реакцию веществ, то он примет следующую формулировку: если вещества вступают в химическую реакцию в газообразном состоянии, то они при одинаковых условиях… Читать ещё >
Общие принципы анализа и расчета процессов и аппаратов (реферат, курсовая, диплом, контрольная)
Материальный и энергетический баланс процесса
Анализ химико-технологического процесса начинается с определения условий равновесия системы с учетом законов гидродинамики и термодинамики. Наибольшее число параметров, которые можно изменять, не нарушая равновесие, определяют с помощью известного правила Гиббса для различных систем:

где Ф — число фаз; С — число степеней свободы, т. е. число независимых переменных, значение которых можно произвольно изменять без нарушения числа или вида (состава) фаз в системе; К — число компонентов в системе.
По характерным равновесным и рабочим параметрам определяют движущую силу процесса, используемую для расчета основных размеров аппарата, проектируемого для данного технологического процесса. По данным о равновесии составляют материальный баланс прихода и расхода веществ.

где М," Мк — количество исходных и конечных веществ соответственно.
Материальный баланс в соответствии с законом сохранения массы применим как к системе в целом, так и к отдельным ее частям. В промышленной практике довольно часто приходится иметь дело с вычислениями количественных соотношений между компонентами начальных и конечных продуктов производства, в основе которого лежат физические процессы. При этих процессах не образуется новых компонентов, а только происходит изменение состава продуктов, которые подвергаются обработке или хранению при определенных условиях. Поэтому, составляя материальный баланс этих процессов, следует иметь в виду, что в приходной и расходной его частях участвуют одни и те же компоненты, но только в различных количественных соотношениях. Расчеты технологических процессов, в результате которых происходит химическое изменение вещества, основаны на стехиометрических законах: законе постоянства состава и законе кратных отношений, которые выражают собой взаимное отношение атомов и молекул при их химическом взаимодействии друг с другом.
Согласно закону постоянства состава любое вещество, какими бы способами его не получали, имеет вполне определенный состав.
Закон кратных отношений состоит в том, что при образовании какого-либо простого или сложного вещества элементы в молекуле последнего входят в количествах, равных или кратных их атомному весу. Если же отнести этот закон к объемам, вступающих в реакцию веществ, то он примет следующую формулировку: если вещества вступают в химическую реакцию в газообразном состоянии, то они при одинаковых условиях (Р и Т) могут соединяться только в объемах, которые соотносятся между собой как целые числа.
Материальный баланс любого технологического процесса или части его составляется на основании закона сохранения веса (массы) вещества:

где ZGIICX — сумма весов (масс) исходных продуктов процесса; ZGK0H — сумма весов (масс) конечных продуктов процесса в тех же единицах измерения.
Таким образом, если в какой-либо аппарат или технологический узел поступает GA кг продукта A, GB кг продукта В и т. д., а в результате переработки их получается GC кг продукта Су GD кг продукта D и т. д., а также если в конечных продуктах остается часть начальных продуктов A (GА кг), В (GB кг) и т. д., то при этом должно сохраниться равенство:
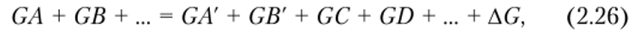
где AG — производственные потери продукта.
Определение массы вводимых компонентов и полученных продуктов производится отдельно для твердой, жидкой и газообразных фаз согласно уравнению.

В процессе не всегда присутствуют все фазы, в одной фазе может содержаться несколько веществ, что приводит к упрощению или усложнению уравнения (2.25).
При составлении полного баланса обычно решают систему уравнений (2.26) с несколькими неизвестными. При этом могут быть использованы соответствующие формулы для определения равновесного и фактического выхода продукта, скорости процесса и т. д.
Теоретический материальный баланс рассчитывается на основе стехиометрического уравнения реакции и молекулярной массы компонентов.
Практический материальный баланс учитывает состав исходного сырья и готовой продукции, избыток одного из компонентов сырья, степень превращения, потери сырья и готового продукта и т. п.
Из данных материального баланса можно найти расход сырья и вспомогательных материалов на заданную мощность аппарата, цеха, себестоимость продукта, выходы продукта, объем реакционной зоны, число реакторов, производственные потери.
Результаты этих подсчетов обычно сводят в таблицу материального баланса (табл. 2.2).
Расчеты выполняют обычно в единицах массы (кг, г), можно расчет вести в молях. Только для газовых реакций, идущих без изменения объема, в некоторых случаях возможно ограничиться составлением баланса в м3. Материальный баланс составляется (в зависимости от условий и задания) на единицу (1 кг, 1 кмоль и т. п.), или на 100 единиц (100 кг), или на 1000 единиц (1000 кг) массы основного сырья или продукта. Очень часто баланс составляется на массовый поток в единицу времени (кг/с), а иногда на поток, поступающий в аппарат в целом.
Таблица 2.2
Типовая таблица материального баланса.
Приход. | Расход. | ||
Статья прихода. | Количество, кг. | Статья расхода. | Количество, кг. |
Продукт А | GA | Продукт А (остаток). | GA |
Продукт В | GB | Продукт В (остаток). | GB |
Продукт С | GC | ||
Продукт D | GD | ||
Производственные потери. | A G | ||
Итого. | G | Итого. | G |
Расходные коэффициенты — величины, характеризующие расход различных видов сырья, воды, топлива, электроэнергии, пара на единицу вырабатываемой продукции. При конструировании аппаратов и определении параметров технологического режима задаются также условия, при которых рационально сочетаются высокая интенсивность и производительность процесса с высоким качеством продукции и возможно более низкой себестоимостью.
Себестоимостью называется денежное выражение затрат данного предприятия на изготовления и сбыт продукции. Для составления калькуляции себестоимости, т. е. расчета затрат на единицу продукции, определяют статьи расхода и в том числе расходные коэффициенты по сырью, материалам, топливу, энергии и с учетом цен па них рассчитывают калькуляцию. На практике обычно чем меньше расходные коэффициенты, тем экономичнее процесс и соответственно тем меньше себестоимость продукции. Особенно большое значение имеют расходные коэффициенты по сырью, поскольку для большинства химических производств 60—70% себестоимости приходится на эту статью.
Для расчета расходных коэффициентов необходимо знать все стадии технологического процесса, в результате осуществления которых происходит превращение исходного сырья в готовый продукт.
Теоретические расходные коэффициенты Лт учитывают стехиометрические соотношения, по которым происходит превращение исходных веществ в целевой продукт. Практические расходные коэффициенты Апр кроме этого учитывают производственные потери на всех стадиях процесса, а также побочные реакции, если они имеют место.
Расходные коэффициенты для одного и того же продукта зависят от состава исходных материалов и могут значительно отличаться друг от друга.
Изменение тепловой энергии системы можно описать уравнением теплового баланса:
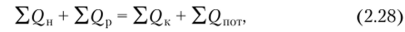
где EQ, EQk — теплота, поступающая в аппарат с исходными материалами, и теплота, отводимая из аппарата с конечными продуктами; Е (2Р — тепловой эффект процесса; ?<2П0Т — потери теплоты в окружающую среду.
Применительно к тепловому балансу закон сохранения энергии формулируется следующим образом: приход теплоты в данном аппарате (или производственной операции) должен быть равен расход}' теплоты в том же аппарате (или операции).
Для аппаратов (процессов) непрерывного действия тепловой баланс, как правило, составляют на единицу времени, а для аппаратов (процессов) периодического действия — на время цикла (или отдельного перехода) обработки.
Тепловой баланс рассчитывают по данным материального баланса с учетом тепловых эффектов (экзотермических и эндотермических) химических реакций и физических превращений (испарение, конденсация и т. п.), происходящих в аппарате с учетом подвода теплоты извне и отвода ее с продуктами реакции, а также через стенки аппарата.
Тепловой баланс, подобно материальному, выражают в виде таблиц, диаграмм, а для расчета используют следующее уравнение: 
где Qt, (2ж. (2, — количество теплоты, вносимое в аппарат твердыми, жидкими и газообразными веществами соответственно; (2т, (2ж> <2г— количество теплоты, уносимое из аппарата выходящими продуктами и полупродуктами реакции и не прореагировавшими исходными веществами в твердом, жидком и газообразном виде; (2ф и (2ф — теплота физических процессов, происходящих с выделением и поглощением ((2ф) теплоты; Qp и Q'p — количество теплоты, выделяющееся в результате экзои эндотермических реакций (Qp); Q" — количество теплоты, подводимое в аппарат извне (в виде дымовых газов, нагретого воздуха, сжигания топлива, электроэнергии и т.и.); Q[, — потери тепла в окружающую среду, а также отвод тепла через холодильники, помещенные внутри аппарата.
Величины Qt, (2ж> Qг> Qt> <2ж, Qr рассчитывают для каждого вещества, поступающего в аппарат и выходящего из него, по формуле 
где G — количество вещества; с — средняя теплоемкость этого вещества; t — температура, отсчитанная от какой-либо точки (обычно от 0°С).
Теплоемкости газов в ДжДкмольК), участвующих в процессе, для дайной температуры в °С (или ТК) можно подсчитать, пользуясь формулой.

Коэффициенты ао, «2 приведены в справочниках.
Чаще всего приходится иметь дело со смесями веществ. Поэтому в формулу (2.30) подставляют теплоемкость смеси ссм, которая может быть вычислена, но закону аддитивности. Так, для смеси трех веществ в количестве G, G2 и G3, имеющих теплоемкости С> с2 и с3,.

Суммарная теплота физических процессов, происходящих в аппаратах, может быть рассчитана по уравнению.
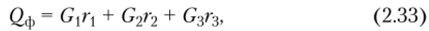
где rh Г4 и 7*3 — теплота фазовых переходов; G, G2 и G3 — количества смеси, претерпевших фазовые переходы в данном аппарате.
Количество членов в правой части уравнения (2.33) должно соответствовать числу индивидуальных компонентов, изменивших в аппарате свое фазовое состояние.
Аналогично рассчитывается расход теплоты на те физические процессы, которые идут с поглощением теплоты (Ql): десорбция газов, парообразование, плавление, растворение и т. п. Тепловые эффекты химических реакций могут быть рассчитаны на основе теплот образования или теплот сгорания веществ, участвующих в реакции. Так, по закону Гесса тепловой эффект реакции определяется как разность между теплотами образования всех веществ в правой части уравнения и теплотами образования всех веществ, входящих в левую часть уравнения.
Например, для модельной реакции: A+B = D + F + qp изобарный тепловой эффект будет:
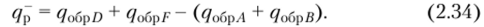
Изобарные теплоты образования из элементов различных веществ q~ (или —All°) приведены в справочниках физикохимических, термохимических или термодинамических величин. При этом в качестве стандартных условий приняты: температура 25 °C, давление 1,01 • 10л Па и для растворенных веществ — концентрация 1 моль на 1 кг растворителя. Газы и растворы предполагаются идеальными.
Тепловой эффект реакции также равен сумме теплот образования исходных веществ за вычетом суммы теплот образования продуктов реакции:

Для определения зависимости теплового эффекта реакции от температуры применяется уравнение Нернста:

где Да0. Дя|, Д"2 — разности соответственных коэффициентов уравнения (2.36) для продуктов реакции и исходных веществ. Значения этих коэффициентов для отдельных реакций приведены в справочниках.
Подвод теплоты в аппарат Q, можно учитывать по потере количества теплоты теплоносителя (например, греющей воды GB и св):

и пара:

или же по формуле теплопередачи через греющую стенку:

где kf — коэффициент теплопередачи; F — поверхность теплообмена; tr — средняя температура греющего вещества (воды, пара); tx — средняя температура нагреваемого вещества в аппарате; г — теплота испарения; т — время.
По этой и другим формулам теплопередачи можно также рассчитать отвод теплоты от реагирующей смеси в аппарате или потерю теплоты в окружающую среду QB. Эту статью расхода теплоты часто вычисляют по изменению количества теплоты хладагента, например, охлаждающей воды или воздуха.
Теплоту, получаемую при сжигании топлива или при превращении электрической энергии в тепловую, подсчитывают по формулам:
• для пламенных печей.

• для электрических печей.

где В — расход топлива, м3/с или кг/с; QU — низшая теплота сгорания топлива, Дж/м3 или Дж/кг; N — мощность печи, Вт; Р — размерный коэффициент.
При подсчетах теплоты сгорания топлива по его элементарному составу в технических расчетах чаще всего используют формулу Менделеева: 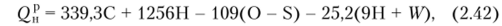
где С, Н, О, S — соответственно содержание углерода, водорода, кислорода и серы, мае. %; W — содержание влаги в рабочем топливе (с учетом содержания в нем А% золы, N% азота), мае. %.
Высшая теплота сгорания Q% вычисляется при условии, что вся вода, образовавшаяся при сгорании, влага, первоначально содержащаяся в топливе, конденсируется из отходящих газов в жидкость и охлаждается до первоначальной температуры, с которой поступает топливо в топку, определяется по формуле.
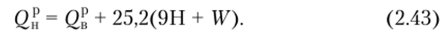
На основе элементарного состава топлива теоретический расход воздуха G кг на 1 кг топлива рассчитывается по уравнению.
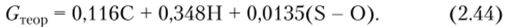
Количество тепла, вносимого влажным воздухом, /вшд, можно подсчитать по формуле.
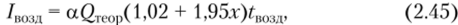
где Greoр — теоретический расход воздуха (кг), идущего на сжигание 1 кг рабочего топлива; а — коэффициент избытка воздуха (практически обычно для твердого топлива, а берется от 1,3 до 1,7); 1,02 — удельная теплоемкость воздуха; 1,95 — удельная теплоемкость водяных паров; х — влагосодержание воздуха (кг) на 1 кг сухого воздуха; ?возд — температура воздуха, поступающего на сгорание.
Для более точного описания процесса применяют термодинамическое моделирование. Термодинамическое моделирование — это математическое моделирование, которое имеет следующие особенности: совокупность допущений о физикохимическом характере системы, условия равновесия (химический состав и термодинамические параметры, характеризующие равновесие системы).