Элементы группы via — группа кислорода

Это различие в электронной структуре отражается на ходе изменения свойств атомов в группе. Так, из-за появления 10 электронов на Зб/-подуровне у селена различие в радиусах атомов между серой и селеном значительно меньше, чем между серой и кислородом (см. табл. 19.1). Следствием этого является большее сходство химических свойств между серой и селеном, чем между серой и кислородом. Элементы группы… Читать ещё >
Элементы группы via — группа кислорода (реферат, курсовая, диплом, контрольная)
Изучив содержание главы 19, студенты должны:
знать
- • положение кислорода и серы в таблице Менделеева, нахождение в природе и практическое применение;
- • строение атомов, валентность, степени окисления кислорода и серы;
- • способы получения и свойства простых веществ — кислорода, озона и серы;
- • основные типы соединений кислорода и серы;
- • особенности элементов подгруппы селена;
уметь
- • составлять уравнения реакций получения кислорода, озона и серы и реакций, характеризующих химические свойства этих веществ;
- • проводить сопоставление свойств элементов в группе кислорода;
- • характеризовать практически важные соединения кислорода и серы;
- • проводить расчеты по уравнениям реакций, в которых участвуют кислород и сера;
владеть
• навыками прогнозирования протекания реакций с участием серы, кислорода и их соединений.
Строение атомов. Распространенность в природе
Элементы группы VIA таблицы Менделеева называют также халькогенами, однако это групповое название употребляется гораздо реже, чем галогены для группы VIIА. Слово «chalkos» в переводе с греческого означает «медь». Следовательно, наиболее точным переводом названия было бы «порождающие медь». Медь в природных рудах обычно бывает связана с серой или кислородом, и отсюда проясняется связь названия целой группы неметаллов с медью. Группу составляют пять элементов — кислород О, сера S, селен Se, теллур Те и полоний Ро (табл. 19.1).
Таблица 19.1
Характеристика элементов группы VIA.
Свойство. | Элемент. | ||||
О. | S. | Se. | Те. | Ро. | |
Порядковый номер | |||||
Радиус г атома (ковалентный), пм. | |||||
Содержание в земной коре со, %. | 47,4. | 2,6 10 2 | 5−10 6 | 5−10 7 | Следы. |
Содержание в организме человека со, % | 61,5*. | 0,2*. | 1,9 10 5*. | 1,2 10 5 |
Свойство. | Элемент. | ||||
О. | S. | Se. | Те. | Ро. | |
Электроотрицательность х. | 3,5. | 2,6. | 2,55. | 2,1. | 2,0. |
Тип структуры простого вещества. | Молекулярная. | Молекулярная. | Каркасная и молекулярная. | Каркасная. | Металлическая. |
* Биогенный элемент.
Их распространенность в природе, хозяйственное и биологическое значение весьма неравноценны. Особенно велико значение кислорода. Возможно, что кислород является наиболее часто упоминаемым химическим элементом и веществом наряду с водой.
Кислород — самый распространенный элемент в земной коре и биосфере (см. табл. 19.1). Он одинаково важен для человека и в виде простого вещества 02, и во множестве неорганических и органических соединений (вода, углекислый газ, белки, углеводы и т. д.). Сера содержится в земной коре в меньшем количестве, но и она находит очень широкое применение, является биогенным макроэлементом. Сера известна с глубокой древности, встречается в природе в виде простого вещества, и химикам не пришлось ее открывать. Существование кислорода как газообразного вещества не было столь очевидно. Он был открыт в XVIII в. почти одновременно Д. Пристли, К. Шееле и А. Лавуазье. Остальные три элемента группы выделяют в подгруппу селена. Селен открыт в 1817 г. И. Берцелиусом, а теллур — в 1782 г. Г. Мюллером (Австрия). С последнего элемента группы полония начинается непрерывный ряд тяжелых радиоактивных элементов. В земной коре нуклидРо (^i/2 = 138 сут) существует только как промежуточный продукт распада 2,<^U. Открыт полоний в 1898 г. М. Склодовской-Кюри. Высокая радиоактивность полония затрудняет его химическое изучение. Опасность этого элемента усиливается тем, что он легко восстанавливается в летучее водородное соединение РоН2. Поэтому радиоактивное вещество из раствора может попадать в воздух.
Рассматриваемые элементы имеют четные порядковые номера, с чем связано наличие у каждого из них по нескольку стабильных изотопов. Естественно, что это не относится к полонию.
Элементы группы VIA имеют во внешнем энергетическом уровне на один электрон меньше, чем стоящие справа от них галогены. Этим обусловлено понижение электроотрицательности и неметаллического характера элементов. Начиная с селена элементы группы проявляют усиливающиеся признаки металличности. Теллур можно считать полуметаллом, а полоний следует рассматривать как металл.
На внешних р-орбиталях элементы группы VIA имеют по два неспаренных электрона:
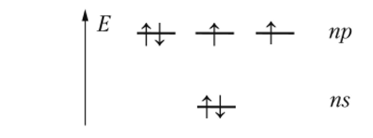
Электронные формулы атомов двух первых элементов группы (кислорода и серы) и элементов подгруппы селена различаются наличием у последних 18-электронной предвнешней оболочки:
О, S — [благородный газ] ns2np4; Se, Те — [благородный газ] (n-i)d]0ns2np4.
Напишем электронные формулы серы и селена: 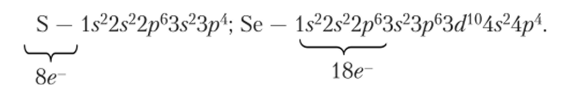
Это различие в электронной структуре отражается на ходе изменения свойств атомов в группе. Так, из-за появления 10 электронов на Зб/-подуровне у селена различие в радиусах атомов между серой и селеном значительно меньше, чем между серой и кислородом (см. табл. 19.1). Следствием этого является большее сходство химических свойств между серой и селеном, чем между серой и кислородом.
Для всех элементов группы VIA характерно двухвалентное состояние. В изученных разделах нам встречались такие вещества, как вода, сероводород, углекислый газ, хлорид серы (П):

Валентность кислорода не может повышаться, так как у него нет свободных орбиталей, достаточно близких по энергии к подуровню 2р. В этом отношении свойства кислорода совпадают со свойствами фтора. Сера и все остальные элементы группы VIA имеют свободные d-орбитали на внешнем уровне, и в возбужденных состояниях становятся четырехи шестивалентными. Состояния повышенной валентности стабилизируются только в соединениях с кислородом, фтором и хлором. В соединениях со всеми другими элементами сера, селен и теллур бывают только двухвалентными.