Фосфор.
Простые вещества

Фосфор является биогенным макроэлементом. Масса фосфора в организме человека составляет приблизительно 750 г. Наибольшая доля его находится в минеральных структурах костей в виде гидроксиапатита Са5(Р04)зОН. Еще более важен фосфор как элемент, составляющий вместе с углеродом и кислородом цепочки полинуклеотидов. Присоединение фосфатных групп НРО^~ и Н2Р ()4 к органическим молекулам… Читать ещё >
Фосфор. Простые вещества (реферат, курсовая, диплом, контрольная)
Фосфор — 15-й элемент таблицы Менделеева, элемент третьего периода. Он принадлежит к числу наиболее распространенных элементов земной коры. Во многих местах встречаются большие залежи фосфатных минералов сложного состава. Важнейший минерал апатит можно приближенно представить формулой Ca5(P04)3(OH, F). Такая запись формулы означает, что гидроксиди фторид-ионы могут в разных соотношениях замещать друг друга. Фторапатит Ca5(P04)3F является минералом постоянного состава. Сложный минерал фосфорит состоит в основном из фосфата кальция Са3(Р04)2, но содержит также карбонат-, гидроксиди фторидионы. Почти во всех природных веществах фосфор находится в окружении из четырех атомов кислорода в группе Р04 вследствие большой прочности связей между кислородом и фосфором.
Фосфор является биогенным макроэлементом. Масса фосфора в организме человека составляет приблизительно 750 г. Наибольшая доля его находится в минеральных структурах костей в виде гидроксиапатита Са5(Р04)зОН. Еще более важен фосфор как элемент, составляющий вместе с углеродом и кислородом цепочки полинуклеотидов. Присоединение фосфатных групп НРО^~ и Н2Р ()4 к органическим молекулам (фосфорилирование) необходимо для передачи энергии в эндоэргонических реакциях биосинтеза и представляет собой обязательную стадию огромного числа биохимических реакций. Фосфорилирование происходит при участии аденозинтрифосфата (АТФ). Как в минералах, так и в веществах живых организмов фосфор постоянно присутствует в виде фосфатов разных типов (твердые минеральные соли, эфиры, анионы фосфорной кислоты в жидких средах организма).
Фосфор относится к числу химических элементов, которые приходится вносить в почву для поддержания урожайности сельскохозяйственных культур. Недостаточное поступление фосфора из почвы в растения обычно связано не с низким содержанием фосфора как элемента, а с крайне низкой растворимостью наиболее часто встречающегося в природе фосфата кальция. Таким образом, как азот, так и фосфор всегда есть рядом с растениями в атмосфере или почве, но оба элемента могут быть практически недоступны для растений из-за низкой реакционной способности или крайне малой растворимости.
По строению атома фосфор — ближайший аналог азота, но образуемые ими простые и сложные вещества имеют мало общего между собой. Фосфор, как и азот, может быть трехвалентным, но, имея свободные Зб/-орбитали, он чаще бывает пятивалентным:

Электроотрицательность фосфора значительно ниже, чем у азота. Он легко окисляется и образует очень устойчивые кислородные соединения.
Фосфор в виде простого вещества можно получать из различных фосфатов, в том числе и из костей. Измельченное соединение фосфора, например фосфат кальция, смешивают с углем как восстановителем и оксидом кремния (песком). Последний играет роль среды, облегчающей процесс восстановления:
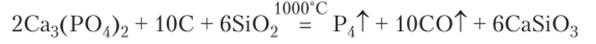
Фосфор выделяется из смеси в виде газообразного вещества, конденсирующегося при охлаждении в желтоватую жидкость — расплавленный белый фосфор. При 44 °C расплавленное вещество переходит в твердое состояние. Так получается белый фосфор. Он представляет собой мягкие, как воск, кристаллы с плотностью 1,82 г/см3, нерастворимые в воде, но растворимые в сероуглероде и бензоле. Фосфор самовозгорается на воздухе. Для замедления окисления его хранят под слоем воды. Белый фосфор имеет молекулярную структуру и состоит из молекул Р4. Атомы фосфора в молекулах расположены по вершинам тетраэдра. Каждый атом связан с тремя остальными атомами данной молекулы. Углы между ребрами тетраэдра — 60°. Следует учитывать, что углы между валентными Зр-орбиталями фосфора — 90°. Очевидно, что связи в молекуле оказываются изогнутыми (бананообразными) с повышенной потенциальной энергией (рис. 20.6). Такие связи легко разрываются, и поэтому белый фосфор химически очень активен и ядовит.
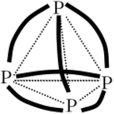
Рис. 20.6. Схема строения молекулы РА
Кроме белого фосфора известны и другие аллотропы — красный и черный фосфор. Каждая из грех форм фосфора имеет структурные разновидности. Поэтому пока нельзя определенно сказать, сколько простых веществ образует фосфор.
Красный фосфор образуется из белого при продолжительном нагревании без доступа воздуха в закрытом сосуде. Постепенно образуется красная аморфная масса. При ее нагревании до 43ГС снова получаются пары, из которых конденсируется белый фосфор. По-видимому, превращение белого фосфора в красный объясняется образованием связей между тетраэдрами Р4:
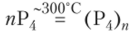
Тогда структуру красного фосфора можно представить следующим образом:
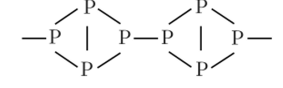
Красный фосфор не растворяется в воде и органических жидкостях. Он относительно безопасен в обращении, гак как не возгорается и неядовит. Человеку приходится держать в руках красный фосфор при добывании огня с помощью спичек. Он содержится в коричневом составе на боковых поверхностях спичечных коробок. При чирканьи головкой спички по поверхности, содержащей фосфор, контакт между частицами неустойчивого хлората калия в головке спички и фосфором на поверхности коробки создает микровспышку, от которой горение распространяется по всей спичечной головке, и далее загорается древесина спички.
Третья форма фосфора — черный фосфор — образуется из белого или красного фосфора при нагревании под давлением 12 000 атм. Это вещество, внешне похожее на графит и имеющее слоистую структуру. Температура плавления — 610 °C. Черный фосфор — хороший проводник электричества.
Своей высокой химической активностью фосфор резко отличается от азота. Для реакций с неорганическими веществами в большинстве случаев можно применять как белый, так и красный фосфор. При написании реакций молекулярный состав фосфора учитывают не всегда.
С водородом фосфор реагирует обратимо с незначительным выходом газообразного соединения, называемого фосфин:
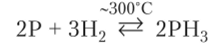
С галогенами образуются летучие соединения с молекулярными структурами (реакцию с хлором см. на с. 19).
При медленном окислении белого фосфора кислородом получается оксид фосфора (Ш) (фосфористый ангидрид). При горении образуется оксид фосфора (У) (фосфорный ангидрид):
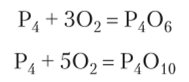
При сплавлении с серой красный фосфор образует несколько веществ в зависимости от состава смеси: P4S3, P4S5, P4S7. Эти же соединения образует с серой и белый фосфор, но реакции с ним идут очень бурно. Сульфиды фосфора применяются в зажигательных смесях.
С металлами s-блока фосфор образует фосфиды, состав которых соответствует ожидаемой в этом случае степени окисления фосфора -3. Фосфид кальция — красно-бурое вещество:
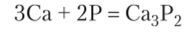
Фосфор реагирует с кислотами и солями, проявляющими окислительные свойства:

Белый фосфор реагирует при нагревании с растворами щелочей, диспропорционируя, подобно галогенам и сере, на два продукта с разными степенями окисления:
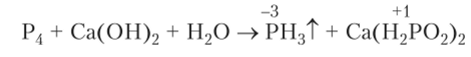
При реакции выделяется газообразный фосфин, а в растворе остается соль фосфорноватистой кислоты (см. далее) гипофосфит кальция.