Химические соединения алюминия

Алюминий образует двойные соли, относящиеся к семейству квасцов. Это двойные сульфаты, содержащие одновременно равное число однозарядных и трехзарядпых катионов. Все квасцы кристаллизуются из растворов с одним и тем же числом молекул воды: Me~Me3+(S04)2−12H20 (Ме+ — К+, Rb+, NH4; Ме3+ — Al3+, Cr3+, Fe3+ и др.). Для квасцов характерно образование крупных октаэдрических кристаллов. Наиболее широко… Читать ещё >
Химические соединения алюминия (реферат, курсовая, диплом, контрольная)
Наиболее многочисленны соединения алюминия, в которых он связан с кислородом. Такими соединениями являются оксид и гидроксид алюминия, соли кислородсодержащих кислот, кристаллогидраты любых солей, природные алюмосиликаты. Соединения алюминия со связями Al-Cl, Al-S, Al-C и другими неметаллами подвергаются, как правило, полному гидролизу. В этом можно убедиться на примере летучего, не солеобразного вещества AlCl3. С водой оно реагирует, образуя кристаллогидрат, фактически являющийся комплексным соединением: 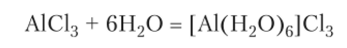
В кристаллогидрате уже нет химических связей между алюминием и хлором, так как при сильном прокаливании его вместо безводного А1С13 образуется оксид:
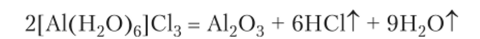
Это подтверждено и изучением кристаллической структуры [ А1(Н20)6]С13.
Более прочные связи, чем кислород, с алюминием образует только фтор. Поэтому фторид алюминия нерастворим в воде и не гидролизуется.
Гидроксид алюминия А1(ОН)3 представляет собой типичное амфотерное вещество. При его осаждении из раствора соли действием щелочи.
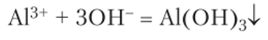
образование осадка можно даже не заметить, так как минимальный избыток щелочи вызывает его растворение. Поэтому гидроксид алюминия чаще получают действием на соли алюминия слабых оснований:
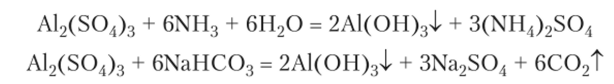
Растворение гидроксида алюминия в щелочи дает тот же продукт, как и растворение в щелочи металлического алюминия:
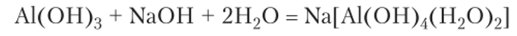
При слабом прокаливании (не выше 300°С) гидроксида алюминия происходит потеря воды и образуется оксид алюминия в активной форме (у-Л1203), растворяющийся как в кислотах, так и в щелочах.
При более сильном нагревании у-А1203, а также при горении алюминия образуется а-А1203, или корунд. Это химически очень стойкое вещество, не реагирующее с растворами кислот и щелочей. Разработана технология выращивания монокристаллов корунда, которые применяются в технике и для изготовления искусственных рубинов и сапфиров. Корунд реагирует со щелочами, карбонатами или оксидами только при сплавлении с образованием мета-алюминатов:
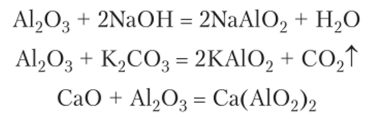
В водеЫаАЮ2 и КАЮ2 растворяются с образованием Na[Al (0H)4(H90)9] и К[А1(0Н)4(Н20)2].
Растворы солей алюминия с анионами сильных кислот имеют кислую реакцию вследствие гидролиза иона алюминия. По силе кислотных свойств А13+ несколько превосходит уксусную кислоту.
Гидролиз А13+ приводит к тому, что обменные реакции в растворах редко приводят к образованию осадков нерастворимых солей, вместо которых выпадает гидроксид алюминия. Осадок фосфата алюминия образуется при реакции соли алюминия с гидрофосфатом натрия или калия:
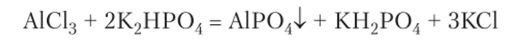
Реакция между солыо алюминия и солыо уксусной кислоты дает осадок малорастворимого основного ацетата алюминия:
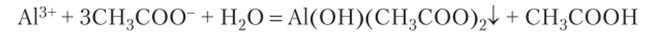
Алюминий образует двойные соли, относящиеся к семейству квасцов. Это двойные сульфаты, содержащие одновременно равное число однозарядных и трехзарядпых катионов. Все квасцы кристаллизуются из растворов с одним и тем же числом молекул воды: Me~Me3+(S04)2-12H20 (Ме+ — К+, Rb+, NH4; Ме3+ — Al3+, Cr3+, Fe3+ и др.). Для квасцов характерно образование крупных октаэдрических кристаллов. Наиболее широко известны калиево-алюминиевые квасцы KAl (S04)2*12H20. Эта соль обладает дубящим действием. В безводном состоянии KA1(S04)2 (жженые квасцы) применяют как присыпку, потому что в кристаллогидрат она превращается медленно и во влажной среде долго сохраняет свои свойства.
Алюминий образует и соединения с углеродными фрагментами молекул, т. е. металлоорганические соединения. Такие вещества, как А1(С2Н5) С12, А1(С2Н5)2С1 и др., входят в состав сложных катализаторов, применяемых для полимеризации этилена.