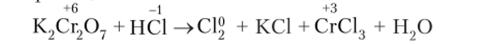Направление окислительно-восстановительных процессов

Любой окислительно-восстановительный переход представляется полуреакцией, которая учитывает участие в процессе не только окисленной и восстановленной форм вещества, но и молекул и ионов среды. Поскольку уравнение В. Нернста записывается на основании уравнения полуреакции, то очевидно, что величина потенциала может зависеть от концентрации ионов Н+. Например, в кислой среде переходу МпО~ в Мп2… Читать ещё >
Направление окислительно-восстановительных процессов (реферат, курсовая, диплом, контрольная)
Очень важным в окислительно-восстановительных процессах является определение возможности и направления их самопроизвольного протекания. Возможность и направление таких процессов определяется вторым законом термодинамики. Если энергия Гиббса окислительно-восстановительного процесса меньше нуля (AG < 0), то такой процесс термодинамически возможен и самопроизвольно протекает в прямом направлении. Если ДG для этого процесса больше нуля, то процесс самопроизвольно проходит в обратном направлении.
Обычно процесс между окислителем и восстановителем протекает в направлении, которое приводит к образованию более слабого окислителя и более слабого восстановителя. Мерой окислительно-восстановительной способности веществ служат их окислительно-восстановительные потенциалы (Е). Сравнивая в первом приближении потенциалы двух сопряженных пар, можно принципиально решить вопрос, какая из них будет играть роль окислителя, а какая — восстановителя. Для этого на практике пользуются стандартными значениями окислительно-восстановительных потенциалов (?°). Чем ниже алгебраическое значение стандартного потенциала сопряженной пары, тем больше восстановительная способность ее восстановленной формы и меньше окислительная способность ее окисленной формы, и наоборот.
Зависимость электродного потенциала от концентрации окисленной и восстановленной форм вещества в растворе выражается уравнением В. Нернста:
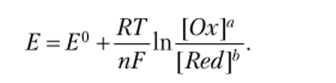
Подставляя числовые значения постоянных величин (/? = 8,314 Дж/моль, F= 96 500 Кл) и переводя натуральный логарифм в десятичный (In = 2,3 lg), получим при Т = 298 К:
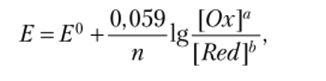
где ?° — стандартный электродный потенциал, В; п — число электронов, участвующих в процессе окисления-восстановления; [Ох] и [Red] — концентрации окисленной и восстановленной форм вещества соответственно; а и b стехиометрические коэффициенты окислительно-восстановительной реакции.
Если под действием какого-либо реагента окисленная или восстановленная форма вещества выпадает в осадок или связывается в комплексное соединение, то активности aQx и aRe (Ji а иногда и обеих форм сразу, существенно уменьшаются. Очевидно, что это вызовет заметное уменьшение или увеличение величины E0x/Red.
Любой окислительно-восстановительный переход представляется полуреакцией, которая учитывает участие в процессе не только окисленной и восстановленной форм вещества, но и молекул и ионов среды. Поскольку уравнение В. Нернста записывается на основании уравнения полуреакции, то очевидно, что величина потенциала может зависеть от концентрации ионов Н+. Например, в кислой среде переходу МпО~ в Мп2+, описываемому полуреакцией:
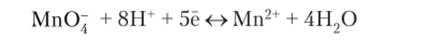
отвечает уравнение Нернста: 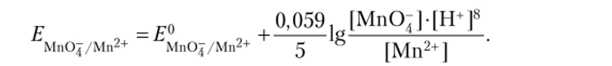
После преобразования легко получается уравнение:
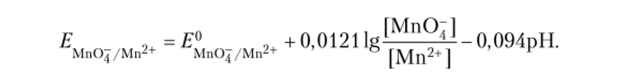
Из приведенного уравнения видно, что увеличение pH раствора будет приводить к заметному уменьшению Е о. При стандартных концентрациях МпО: и Мп2+
М1Ю4 /Мп2+ Г 4.
И РН = 0; ?МпО;/м"2+ = 1'507 в— а ИР'1 РН = 5 ?м"о4-/Мп2+ =.
Для самопроизвольного протекания окислительновосстановительного процесса необходимо, чтобы алгебраическая величина потенциала одной сопряженной пары была бы больше другой и, следовательно, чтобы разность потенциалов сопряженных пар была величиной положительной. Процесс протекает до тех пор, пока потенциалы обеих пар не станут одинаковыми, после чего в системе устанавливается химическое равновесие, характеризуемое константой химического равновесия, которая для окислительно-восстановительных реакций может быть выражена следующей формулой:

При рассмотрении окислительно-восстановительных свойств соединений любого химического элемента в растворах очень удобны диаграммы В. М. Латимера, которые в наглядной форме дают информацию:
- • о возможных окислительно-восстановительных превращениях, происходящих с элементом и всеми его соединениями в конкретной среде (кислой, нейтральной или щелочной);
- • об устойчивости соединения элемента в данной степени окисления относительно реакций диспропорционирования;
- • об окислительно-восстановительном взаимодействии с растворителем, в частности, с водой.
Диаграмма Латимера — это записанные в порядке убывания степеней окисления все возможные формы элемента в конкретной среде, соединенные друг с другом стрелками, указывающими восстановительные переходы. Над стрелкой указывается соответствующее значение потенциала E0x/Red той пары, которую связывает стрелка.
Диаграммы Латимера для отдельных элементов Периодической системы элементов приведены в соответствующих главах второго раздела данного пособия «Неорганическая химия». Например, диаграмма Латимера для марганца в кислой среде имеет вид (потенциалы приведены в В):
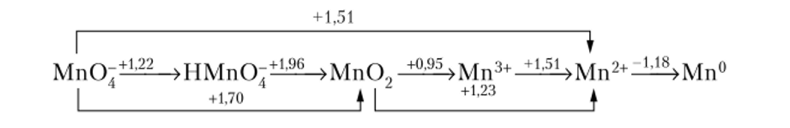
Из диаграммы Латимера можно получить следующую информацию:
1) о самом сильном окислителе (шах значение Е°) и самом сильном восстановителе (min значение ?°).
Из всех форм марганца в кислой среде самый сильный окислитель ион — НМпОт (?° Л w Л = 1,96 В), самый.
4 v НМПО4/М1Ю2 7
сильный восстановитель — Мп° (Е° 9. w = -1,18 В);
«ч х Мп-+/Мп0
- 2) о возможности протекания реакций диспропорционирования.
- 11а диаграммах Латимера легко выделить формы элемента, способные к реакциям диспропорционирования. Как правило, значения Е° постепенно уменьшаются слева направо; хорошие восстановители расположены справа, хорошие окислители — слева, а устойчивые формы в центре диаграммы. Когда монотонное уменьшение значений Е° нарушается, возникает возможность реакции диспропорционирования вещества. Как следует из диаграммы, для марганца такие аномалии наблюдаются для двух форм: НМпО~ и Мп3+. Оба иона в кислой среде будут диснропорционировать:
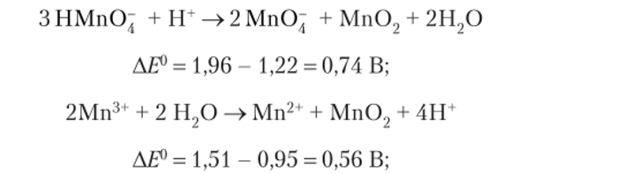
3) об устойчивости различных форм элемента к окислению водой или ионами водорода.
Стандартный потенциал восстановления Н+ в кислой среде (Е° = 0,00 В) превышает только потенциал перехода Мп2+ Мп° (Е° = -1,18 В). Следовательно, из всех веществ, приведенных в диаграмме, только Мп° будет окисляться протонами: 
4) об устойчивости различных форм элемента к восстановлению кислородом воды.
Стандартный потенциал окисления воды в кислой среде равен 1,23 В. Следовательно, соединения марганца, имеющие большее значение потенциала, могут восстанавливаться атомом кислорода воды:
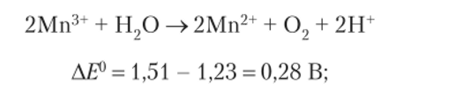
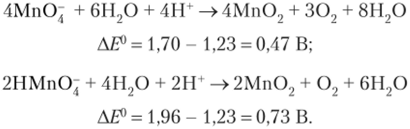
Наиболее распространенные окислительно-восстановительные реакции.
Реакции с участием перманганата калия (КМпО,) в качестве окислителя
При взаимодействии КМп04 с восстановителем образуются различные продукты восстановления в зависимости от pH среды.
Реакции в кислой среде
Схема реакции: 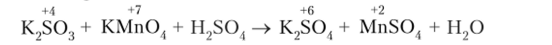 Электронный баланс:
Электронный баланс:
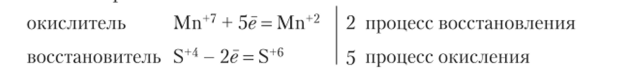
Ионно-электронный баланс:
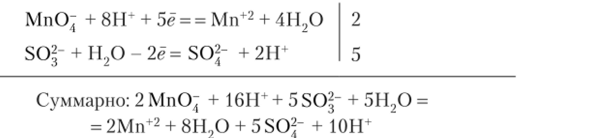
После сокращения:
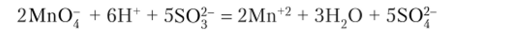
В молекулярной форме:
- 5K.SO, + 2KMnO, + 3II. SO, = 6K.SO. + 2MnSO, + ЗП., 0
- 2 6 4 14 2 4 4 2
Фиолетовый раствор КМп04 обесцвечивается при добавлении раствора K2SO.}
Реакции в нейтральной среде Схема реакции:
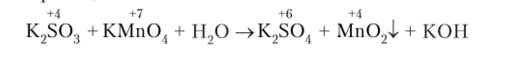
Электронный баланс:
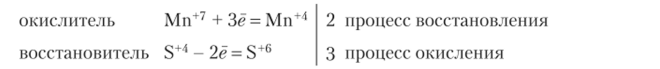
Ионно-электронный баланс:
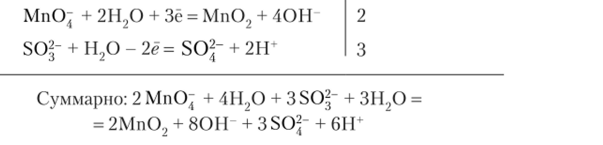
После сокращения:
В молекулярной форме: 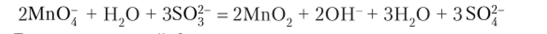

Фиолетового цвета раствор КМп04 изменяет цвет. Наблюдается выпадение бурого осадка диоксида марганца Мп02. Реакции в щелочной среде Схема реакции:

Электронный баланс:
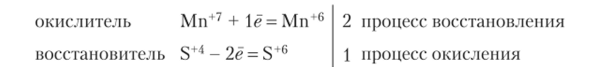
Ионно-электронный баланс:
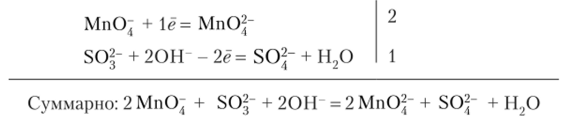
В молекулярной форме:
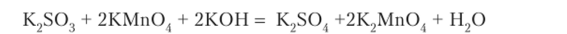
Фиолетовый раствор КМп04 превращается в раствор К2Мп04 изумрудного цвета.
Реакции с участием дихромата калия (К., Сг.;07) в качестве окислителя
Степень окисления хрома в этом соединении в данном случае понижается с +6 до +3. Наблюдается изменение окраски реакционной массы с желто-оранжевого цвета до зеленого или фиолетового.
1. Схема реакции:
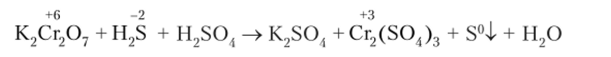
Электронный баланс:
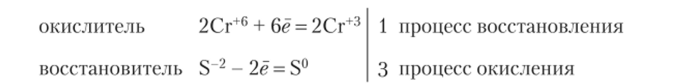
Ионно-электронный баланс: 

Суммарно: 6Fe+2 + Сг202" + 14Н1 = 2Сг+3 + 6Fe‘3 + 7H2Q.
В молекулярной форме:
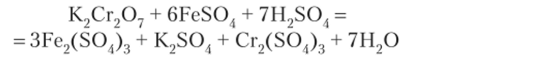
3. Схема реакции: Электронный баланс: