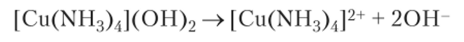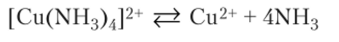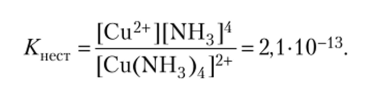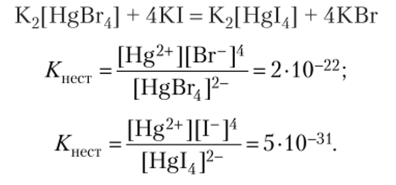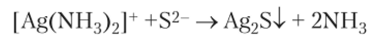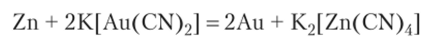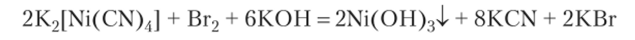В водных растворах комплексные соединения полностью диссоциируют на ионы внешней и внутренней сферы, так как связь между ними ионная:
Нейтральные комплексные соединения не диссоциируют на ионы, т. е. являются неэлектролитами. Комплексный ион — слабый электролит диссоциирует на ион-комплексообразователь и лиганды обратимо:
Прочность комплексного иона, характеризующаяся константой диссоциации, называется константой нестойкости:
Чем меньше константа нестойкости, тем прочнее комплексный ион. Поскольку процесс диссоциации комплексного иона обратим, то равновесие можно сместить вправо и вызвать разрушение комплекса, если в раствор ввести вещество, связывающее комплексообразователь или лиганды в более прочное соединение в соответствии с правилом Бертолле.
Например, комплексное соединение K2|HgBr4] будет разрушаться при добавлении в раствор иодида калия с образованием нового соединения K2[HgI4] — комплексного иона, который является более слабым электролитом:
Комплексный ион может разрушаться в случае образования труднорастворимого соединения. Так, комплексный ион [Ag (NH3)2]+ разрушается при добавлении в раствор сульфида калия и образованием сульфида серебра, который имеет ПР = 5,9 • • 10 52, тогда как константа нестойкости комплексного иона Кп = = 6,8- 10−8:
Комплексные соединения могут вступать в окислительно-восстановительные реакции замещения иона-комплексообразователя:
Металлический цинк замещает золото в составе комплекса, образуя при этом более прочный тетрацианоцинкат-ион.
В некоторых ОВР происходит разрушение комплекса с образованием более простых по составу продуктов реакции:
В этой реакции ион никеля окисляется бромом до степени окисления +3. В щелочной среде ион никеля образует малорастворимый гидроксид, выпадающий в осадок. Таким образом, свойства комплексных соединений в растворах подчиняются правилу Бертолле.