Фазовое равновесие в растворах полимеров. 0-условия

Исключенный объем. Разность а5 — а3 = г в теории растворов Флори — Хаггинса — один из важнейших параметров, который связан с исключенным объемом макромолекулы. В разбавленных растворах сегменты статистически свернутых макромолекул не могут занять положений, уже занятых другими сегментами. Эффективный исключенный объем сегмента рс, учитывающий вероятность того, что в занятом им объеме не может… Читать ещё >
Фазовое равновесие в растворах полимеров. 0-условия (реферат, курсовая, диплом, контрольная)
Рассмотренные выше диаграммы фазового состояния систем «полимер — растворитель» (см. рис. 2.2 и 2.3) должны следовать и из теории растворов. Если раствор расслаивается на две фазы, то в критической точке должны соблюдаться условия.
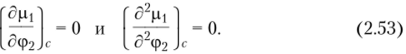
После дифференцирования уравнения (2.48) по <�р2 и соответствующих преобразований были получены следующие выражения: • для критической концентрации:

• для критического параметра взаимодействия:
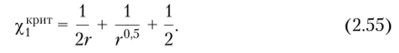
Из выражений (2.54) и (2.55) следует, что при очень больших молекулярных массах (г —* °°) ф?рит стремится к нулю, а Х]Кр" т = = 0,5. Действительно, для большинства систем «полимер — растворитель» критическая концентрация при расслаивании на две фазы мала, а кривая фазового равновесия смещена в область больших разбавлений.
Для очень разбавленных растворов приведенные выше уравнения могут быть упрощены. Так, выражение (2.43) для парциальной энтропии после разложения в ряд члена 1н (1 — ф2) и оставления только двух первых членов ряда преобразуется к виду.
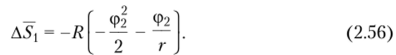
При больших значениях г можно пренебречь и членом ф2//‘, что приводит к следующему выражению:

В окончательное выражение для парциальной энтропии смешения Флори ввел множитель 2^, учитывающий влияние природы растворителя на некомбинаториальную составляющую энтропии смешения (2^ = 1 — xi). и получил.

Уравнение (2.40) для парциальной энтальпии представляется в виде.

где k — тепловой параметр, характеризующий различие взаимодействий элемента цепи с растворителем молекул растворителя (/:'i |) и элементов цепи (?'22):
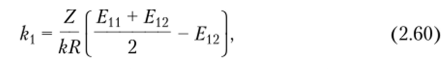
где Z — координационное число ближайших соседей; k — постоянная Больцмана.
Для очень разбавленных растворов изменение химического потенциала растворителя может быть определено с учетом выражений (2.58) и (2.59):
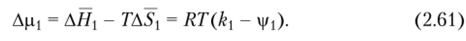
Но если в уравнение Apj = АН — TAS[ подставить значения 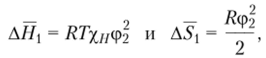 то Ajlxj можно выразить следующим образом:
то Ajlxj можно выразить следующим образом:
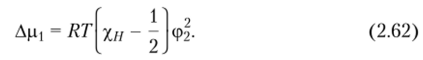
Из сопоставления уравнений (2.61) и (2.62) следует.

Если в уравнение (2.62) ввести параметр 0, определяемый соотношением.

то получим.
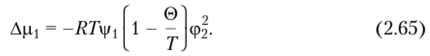
Из уравнений (2.64) и (2.65) следует, что параметр © имеет размерность температуры; его называют (c)-температурой или температурой Флори. Его физический смысл заключается в следующем.
Для идеального раствора Ар, = ДЛпХ), и если он разбавлен, toxj —*? 1, lnxj —" 0 и Ар, —*? 0. Это возможно, если 0 = Т. Следовательно, (c)-температура — это такая температура, при достижении которой в разбавленном растворе не наблюдается отклонения от идеальности.
В идеальных растворах к = RTc2, следовательно, при 0-температуре второй вириальный коэффициент становится равным нулю. Чаще всего (c)-температуру определяют экстраполяцией температурной зависимости А2 к нулевому значению.
Из уравнений (2.63) и (2.64) получено выражение, показывающее зависимость (c)-температуры от х]фИТ:
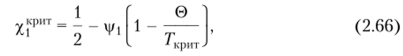
где Гкрит — критическая температура смешения.
После комбинации последнего уравнения с уравнением (2.55) и замены г на молекулярную массу полимера М получим.

где К — коэффициент, определяемый по наклону прямой 1 (рис. 2.6).
При М — °о 1/М0'5 — 0 и Гкрит = 0.
Следовательно, (c)-температура — это критическая температура растворения полимера бесконечно большой молекулярной массы. Поэтому 0-температуру можно найти, определяя критическую температуру смешения различных фракций полимера в одном и том же растворителе и экстраполируя зависимость 1/Гкрит = = /(1/М0,5) к 1/М0,5 = 0 (см. рис. 2.6, прямая 1).
В этом случае ф?рит можно рассчитать по уравнению (2.54). Положение верхней критической температуры в рассматриваемой теории характеризуется следующим соотношением:

Теория Флори — Хаггинса не может объяснить существования систем «полимер — растворитель» с нижней критической температурой смешения (Тнктс), когда взаимная растворимость с понижением температуры улучшается (рис. 2.7). Общим условием.
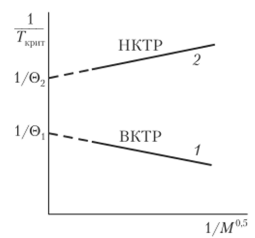
Рис. 2.6. Определение (c)-температуры по зависимости.
1/Гкрит от 1/М0,5
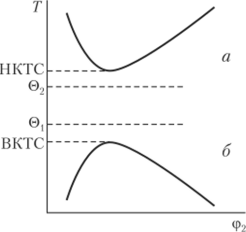
Рис. 2.7. Фазовая диаграмма «температура — состав» для растворов полимеров с нижней (а) и верхней (б) температурами смешения и верхней (0j) и нижней (®2) (c)-температурами существования НКТС являются неравенства АН < 0 и AS < 0, в то время как для верхней критической температуры смешения выполняются условия АН > 0 и AS > 0. При наличии в системе НКТС появляется вторая (c)-температура, которая может быть определена по зависимости 1 /Гкрит=/(1 /М0,5) (см. рис. 2.6, прямая 2). Вторую 0-температуру называют температурой Роулинса. Следовательно, если система обладает верхней и нижней температурами смешения, то она должна иметь и две (c)-температуры (см. рис. 2.7). Формально 7'вктс и 7'нктс можно выразить через параметры vp| и k. Так как при указанных температурах Ар, = 0, то из уравнения (2.61) следует, что &i — vpt = 0; значит, температурная зависимость (k{ — vp 1) обладает максимумом при некоторой температуре, лежащей между 7цктси Гвктс (рис. 2.8). Температуры, при которых разность (к{ — vpj) равна нулю, соответствуют указан ным тем иературам.
Из рис. 2.8 очевидно, что |/( уменьшается, становится отрицательной и продолжает уменьшаться с повышением температуры. Отрицательное значение vpj свидетельствует о том, что энтропия растворителя при растворении полимера уменьшается. Аналогично изменяется с температурой и к. при высоких температурах к < 0 и А//) < 0, что может быть следствием различий коэффициентов теплового расширения растворителя и полимера и связанного с этим изменения объема при смешении.
Приведенные в табл. 2.10 значения 0-температур для ряда систем «полимер — растворитель» показывают, что для некоторых полимеров они могут быть достигнуты только в смешанных растворителях.
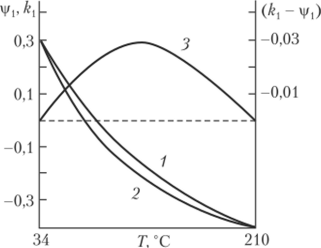
Рис. 2.8. Температурная зависимость коэффициентов р( (/), kt (2) и (&, — у,) (3) для системы «полистирол — циклогексан», обладающей верхней и нижней критическими температурами смешения.
Таблица 2.10
(c)-температуры для некоторых систем «полимер — растворитель».
Полимер | Растворитель. | Температура[1], С. |
Полиакриловая кислота. | Диоксан-1,4. | |
1,4-дг/ополибутадиен. | Изобутилацетат. | 20,5. |
Поливинилацетат. | З-Гептанол. | |
Поливинилхлорид. | Диметилформамид. | 36,5. |
Тетрагидрофуран: вода (89,4: 10,6 об.%). | 31,5. | |
Полистирол. | Циклогексан. | 34 и 210[2] |
Толуол: метанол (75,2:24,8 об.%). | ||
Бутанол: изопропанол (85,7: 14,3 об.%). | ||
ПММА. | Ацетонитрил. | 27,6. |
З-Гептаион. | 33,7. | |
Пол и изобутилен. | Бензол. | |
Полиэтиленоксид. | 0,45 М раствор в воде. | |
Полидимстилсилоксан. | Бромциклогсксан. | |
Тетралин. |
Растворитель, в котором при указанной температуре достигаются (c)-условия, называют 0-растворителем. В (c)-условиях раствор полимера является идеальным, а его макромолекулы принимают конформации, «невозмущенные» взаимодействием с растворителем и определяемые только гибкостью цепи, т. е. ее химическим строением. Сопоставление найденных расчетным путем и определенных экспериментально в (c)-условиях значений квадрата расстояний между концами цепи h2 и квадрата радиуса инерции макромолекулы R2 позволяет оценить степень заторможенности внутреннего вращения в полимерных цепях.
В зависимости от термодинамического качества растворителя макромолекулы гибкоцепных полимеров в разбавленном растворе будут иметь различные формы (рис. 2.9): развернутого рыхлого клубка — в хорошем, более свернутого (гауссовского) клубка — в (c)-растворителе. В термодинамически плохом растворителе вследствие преимущественного взаимодействия между участками цепи она свернется в плотную компактную глобулу. Концентрация насыщения в плохих растворителях невысока, так как при частых взаимных контактах глобул происходят их агрегация и последующее выпадение из раствора (расслоение).
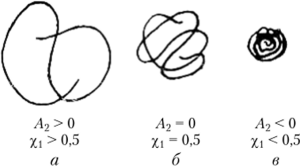
Рис. 2.9. Схематическое изображение гибкой макромолекулы в хорошем (а), плохом (в) и (c)-растворителе (б).
Для характеристики разбухания (или сжатия) клубка в растворе используют параметр а, определяемый из соотношений.
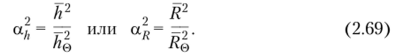
Различие между ajj и обусловлено тем, что разбухание клубка макромолекулы в хорошем растворителе несколько анизотропно. Изменение энергии Гиббса клубка в растворе, вызванное набуханием, в теории растворов выражается уравнением.
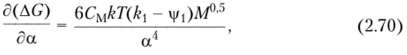
где См — константа; k — постоянная Больцмана; М — молекулярная масса полимера.
Разбухание клубка вызывает его растяжение и противодействие, оказываемое тепловым движением сегментов цепи и выражаемое уравнением.
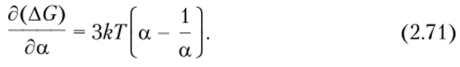
При равновесии эти эффекты выравниваются, следовательно,.
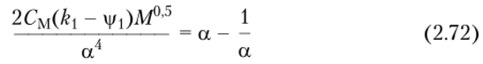
или, с учетом соотношения (2.64),.
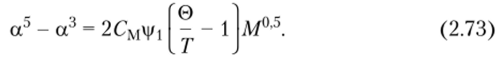
Из уравнения (2.73) следует, что размер реального клубка возрастает с увеличением молекулярной массы и на него влияет энтропийный член Из уравнения (2.73) также очевидно, что при температуре Флори (Т = 0) член а5 — а3 = 0, что возможно только при, а = 1.
Исключенный объем. Разность а5 — а3 = г в теории растворов Флори — Хаггинса — один из важнейших параметров, который связан с исключенным объемом макромолекулы. В разбавленных растворах сегменты статистически свернутых макромолекул не могут занять положений, уже занятых другими сегментами. Эффективный исключенный объем сегмента рс, учитывающий вероятность того, что в занятом им объеме не может находиться другой сегмент, определяется соотношением.
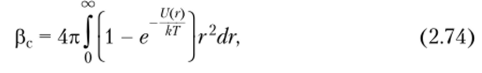
где U® — потенциал взаимодействия двух сегментов в растворе; г — расстояние между взаимодействующими элементами.
Для малых г U® > 0 (отталкивание), при больших г U® < О (притяжение). Эффективный исключенный объем сегмента представляет собой общий результат взаимодействия сил отталкивания и притяжения между элементами системы. В 0-точке рс = О, в хороших растворителях рс > 0.
Исключенный объем макромолекулы рм равен.

где N — число сегментов в цепи.
Параметр 2 для гауссовой цепи связан с рс соотношением.

Таким образом, параметр 2 пропорционален исключенному объему сегмента (или макромолекулы) и обратно пропорционален геометрическому объему макромолекулы (Л — размер сегмента Куна). Параметр z характеризует как исключенный объем сегмента, так и число соударений между сегментами в единице объема макромолекулярного клубка.
Для более точного согласования эксперимента и теории, имеющей ряд ограничений (в частности, не учитывающей взаимодействия дальнего порядка), в соотношение, связывающее набухание клубка и параметр г, был введен ряд числовых коэффициентов, например

Существует много эмпирических зависимостей между (Зс и г, которые можно найти в литературе [4]. Однако величины рс и z нельзя определить экспериментально, поэтому чаще используют зависимости между вторым вириальным коэффициентом Л2 и 2, позволяющие оценить величину исключенного объема. В табл. 2.11 приведены значения (3,., определенные в толуоле, для гомологов полистирола -[-C® (С6Н4-72я/д2-Х)СН2-]"-.
Таблица 2.11
Значения рс, определенные в толуоле, для гомологов полистирола.
Rh X. | СН3 и Н. | Н и Н. | Н и С1. | Н и Вг. |
Рс — 24, см3 | 40,4. | 23,7. | 9,9. | 1,8. |
Для многих полимеров не удается подобрать (c)-растворитель, поэтому невозмущенные «исключенным объемом» размеры клубков могут быть определены по экстраполяционным методикам. Установлено, что параметр исключенного объема z пропорционален М0,5.