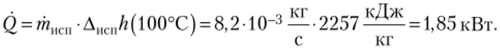Р—v—Т диаграмма воды
При нагреве жидкости вдоль линии ah (объем меньше критического) в автоклаве наблюдается увеличение жидкой фазы, при этом в точке b все вещество переходит в жидкое состояние. Если нагрев проводить вдоль линии 1—2 (объем больше критического), то с повышением температуры и давления объем жидкой фазы будет убывать, а на линии насыщенного пара жидкая фаза исчезнет. Наконец, если нагрев жидкости… Читать ещё >
Р—v—Т диаграмма воды (реферат, курсовая, диплом, контрольная)
Ранее мы рассматривали взаимосвязи между различными термодинамическими параметрами, а также балансовые соотношения. И те, и другие совершенно не зависят от свойств конкретного вещества. При использовании формул мы до сих пор основывались на модели идеального газа и идеальной несжимаемой жидкости, которые можно рассматривать как предельный случай реальных физических моделей веществ. Это самые простые модели, которые оказываются полезными при решении многих практических задач.
В данной главе речь пойдет о свойствах реальных веществ в твердом, жидком и газообразном состояниях. Рассмотрим также вопросы фазовых переходов веществ из одного состояния в другое. Явления такого рода характерны для всех веществ и отличаются только диапазоном температур и давлений. Фазовые переходы играют существенную роль в технических процессах. Свойства вещества зависят от его агрегатного состояния.
Плавление — переход вещества из твердого состояния в жидкое. Обратный процесс называется затвердеванием или замерзанием.
Сублимация — переход из твердого состояния в газообразное, обратный процесс называется десублимацией.
Испарение — переход из жидкого состояния в газообразное, обратный процесс называется конденсацией.
Пар — это газ вблизи температуры конденсации. Пар называется насыщенным, если при произвольно малом охлаждении происходит его конденсация. Пар называется перегретым, если для того чтобы осуществить конденсацию, его нужно охладить на конечную величину ДТ.
Таким образом, газ является сильно перегретым паром. Поскольку любой газ можно перевести в жидкое состояние, принципиальной разницы между паром и газом нет. При достаточно высокой температуре и низком давлении поведение газа хорошо описывается с использованием модели идеального газа.
Жидкость называется насыщенной, если при произвольно малом нагреве происходит кипение. Термины «насыщенная жидкость» и «насыщенный пар» связаны с концепцией «теплорода». В свое время французский химик А. Лавуазье предположил, что жидкость начинает кипеть в тот момент, когда она «насыщается» теплородом, отсюда и термин «насыщенная жидкость». Аналогичные рассуждения можно применить для описания свойств пара в точке начала конденсации.
Для изображения взаимосвязей между состоянием вещества и термодинамическим параметрами широко используются фазовые диаграммы.
Следует отметить, что феноменологическая термодинамика не может сказать ничего о свойствах реального вещества. Эти свойства определяются либо из эксперимента, либо расчетным путем с использованием методов статистической физики. Результаты измерений или расчетов удобно использовать в виде термических и калорических уравнений состояния, а также в виде таблиц и диаграмм.
Рассмотрим воду в качестве примера реального вещества, хотя свойства других веществ в принципе не отличаются от свойств воды. Все вещества ведут себя примерно одинаково, отличаясь лишь числовыми значениями термодинамических свойств. В первую очередь нас будут интересовать жидкая фаза и фазовые переходы, поскольку именно они наиболее значимы в технике.
В двухфазной системе жидкость — пар жидкость отделена от пара видимой границей, при пересечении которой свойства вещества резко меняются. При этом температура и давление одинаковы в обеих фазах. Аналогичная картина имеет место в двухфазной системе вода — лед.
Фаза не обязательно состоит из химически чистого вещества, это может быть и смесь нескольких веществ. Газы почти всегда смешиваются неограниченно, за исключением области очень высоких давлений, в которой возможно расслаивание газов. Поэтому если в системе есть газы, они обычно образуют одну фазу. Среди жидких и твердых веществ есть немало таких, которые с чем-то смешиваются, а с чем-то нет (вода — масло).
Химически чистое вещество может иметь несколько модификаций кристаллических решеток в разном диапазоне параметров (графит, алмаз).
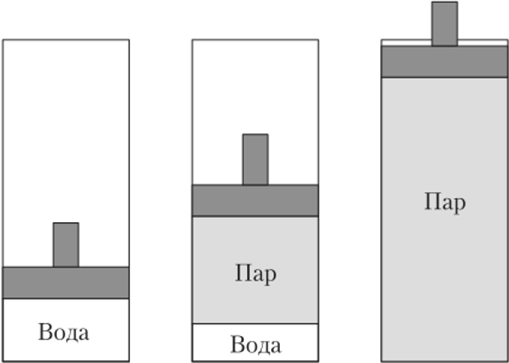
Рис. 10.1. Нагрев воды в цилиндре под поршнем.
Пусть в цилиндре под поршнем находится 1 кг воды при давлении 1 бар и температуре 0 °C (рис. 10.1). Если начать нагревать воду, то поршень будет перемещаться. Вначале он немного опустится, наименьший объем воды под поршнем будет достигнут при 4 °C. При дальнейшем нагревании поршень будет перемещаться вверх.
Уменьшение объема жидкости при нагреве воды от 0 до 4 °C является необычным. В случае воды оно объясняется наличием в жидкости ассоциатов вида Н402 и Нб03, которые имеют разные плотности. Таким образом, чистая вода в действительности является раствором, причем соотношение молекул Н20, Н402 и Н603 зависит от температуры. Если с повышением температуры растет число молекул с более высокой плотностью, то плотность жидкости возрастает, объем уменьшается. Хотя при этом объем жидкости из молекул каждого сорта возрастает!
Когда при постоянном давлении 1 бар температура воды иод поршнем достигает значения 100 °C (строго говоря, 99,632°С), вода закипает, начинает испаряться, объем системы возрастает. При этом температура и давление жидкости и пара одинаковы. Температура системы не меняется при нагреве до тех пор, пока в цилиндре есть две фазы. Состояние, при котором вода и нар находятся в равновесии, называется состоянием насыщения, оно характеризуется давлением насыщения и температурой насыщения. Непосредственно после того, как вся вода превратилась в пар, объем системы при 100 °C в 1673 раза больше объема системы при 4 °C.
Объем жидкой фазы меняется с температурой гораздо меньше объема газовой фазы. Для воды в широком интервале температур в координатах T—v и р—v объем жидкой фазы изображается практически вертикальной линией, поэтому в целях наглядности удобнее пользоваться координатами T-og (v) и p-logO).
Рассмотрим, что происходит с 1 кг жидкой воды при 20 °C, которая находится в цилиндре под поршнем (точка 1 на рис. 10.2). Пусть вода медленно нагревается при постоянном давлении 1 бар. С ростом температуры объем системы возрастает. Далее система попадает на линию насыщения (точка 2 на рис. 10.2). Участок 1—2 изображает состояние недогретой или сжатой жидкости. Жидкость в точке 2 — насыщенная жидкость. При дальнейшем нагреве происходит кипение воды при постоянных давлении и температуре (участок 2—3—4), объем системы при этом быстро растет. В точке 4 вся жидкость испаряется. Дальнейший нагрев приводит к увеличению температуры и объема.
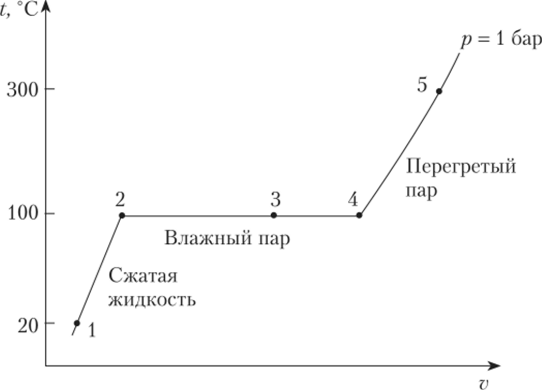
Рис. 10.2. Нагрев воды на T—v диаграмме Двухфазная смесь, жидкость — пар, на участке 2—4 называется влажным паром. Насыщенный пар в точке 4 не содержит влаги, это сухой насыщенный пар. При дальнейшем нагреве системы пар выходит из состояния насыщения. Влажный пар в точке 3 — смесь насыщенной жидкости и сухого насыщенного пара. Пар, температура которого превышает температуру насыщения при данном давлении, называют перегретым паром.
Если осуществлять испарение жидкости при разных давлениях, температура кипения будет меняться (рис. 10.3). Чем выше давление, тем выше проходит изобара на диаграмме.
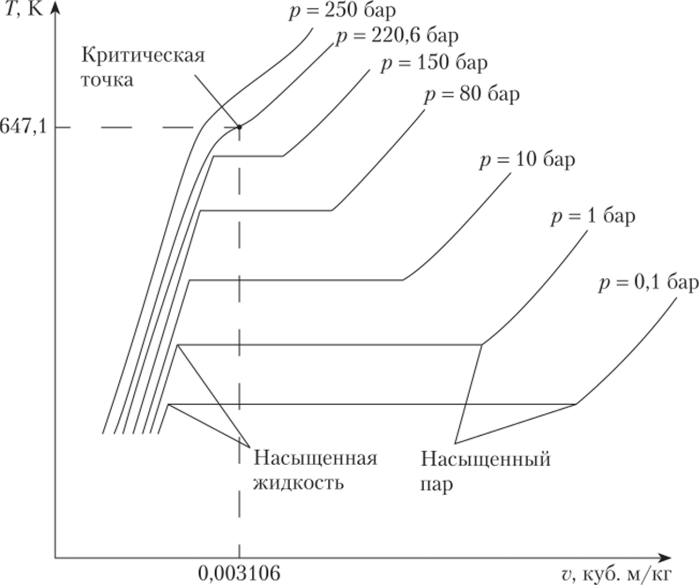
Рис. 10.3. Процессы нагрева и испарения воды при разных давлениях.
на T—v диаграмме.
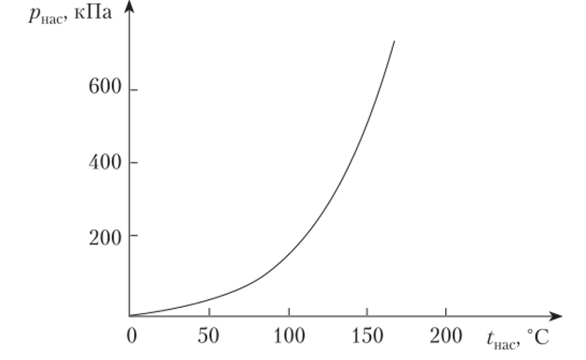
Зависимость давления насыщения от температуры насыщения определяет кривую насыщенного пара (рис. 10.4). Кривая начинается в тройной точке — состояние, в котором сосуществуют три фазы — твердая, жидкая и газообразная. Заканчивается кривая в критической точке, в которой жидкая и газовая фазы непрерывно переходят одна в другую.
Процессы нагрева и испарения вещества можно изобразить в координатах T—log (v) и p—og (v) (рис. 10.5, 10.6). Множество точек, изображающих состояние насыщенной жидкости и насыщенного пара, образует линию насыщения (бинодаль), которая состоит из линии насыщенной жидкости и линии насыщенного пара (см. рис. 10.5).
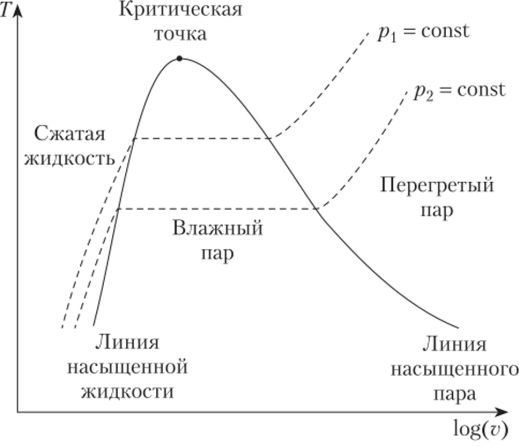
Рис. 10.5. T—log (v) диаграмма чистого вещества.
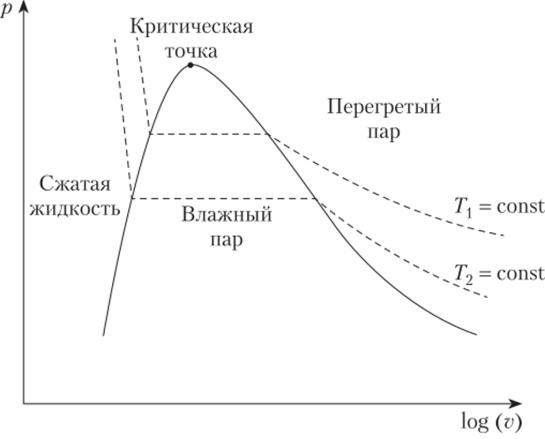
Если сжимать пар при постоянной температуре, давление будет возрастать приблизительно по закону параболы, как для идеального газа (см. рис. 10.6). Как только будет достигнуто давление насыщения, пар начнет конденсироваться. При дальнейшем охлаждении системы, которое сопровождается уменьшением объема, происходит конденсация пара. Когда система попадает в точку на линии насыщенной жидкости, пара в системе больше нет. Если уменьшать объем системы дальше, давление будет резко расти, поскольку жидкость сжимается плохо.
Сжатие можно проводить при разных температурах, при этом на диаграмме получается семейство изотерм. Чем выше температура, тем выше проходит изотерма. Двухфазная область на диаграмме изображается горизонтальным участком области изотермы.
Как видно из графиков T—og (v) и р—log (^), с ростом давления и температуры объем системы при испарении меняется все меньше, а в критической точке испарение жидкости происходит без изменения объема. В критической точке касательная к изотерме проходит параллельно оси абсцисс, кроме того, критическая точка является точкой перегиба на изотерме.
Таким образом, в критической точке выполняются соотношения.
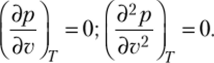
Если нагревать жидкость при давлении выше критического, то температура и объем системы будут расти, но фазового перехода жидкость — пар не наблюдается, жидкость переходит в пар непрерывно, без образования фазовой границы. Такой нагрев происходит иногда в паровых котлах.
Критическое давление — это давление, при котором испарение происходит без изменения объема при постоянной температуре. Жидкая фаза при этом переходит в газовую непрерывно. Температура, при которой происходит такой переход, называется критической температурой, а объем — критическим объемом. Параметры критической точки воды: рк = 220,64 бар, Тк = 647,096 К, г;к = ЗДОб-Ю" 3 м3/кг.
Принято считать, что при давлении, существенно меньше критического, термические свойства пара с приемлемой точностью можно описать с использованием уравнения состояния идеального газа. Поскольку критическое давление большинства веществ гораздо больше атмосферного, поведение многих газов при атмосферном давлении вполне удовлетворительно описывается с использованием модели идеального газа. Однако в общем случае для описания свойств водяного пара необходимо использовать более реалистичное уравнение состояния.
Если сжимать газ при температуре выше критической, то ни при каком давлении нельзя перевести газ в жидкое состояние. По этой причине долгое время считалось, что есть газы, которые невозможно перевести в жидкое состояние. Только после создания технологии достижения очень низких температур удалось перевести в жидкое состояние такие газы.
Семейство кривых, изображенное на р—v и Т— v диаграммах, — это графическое изображение уравнения состояния вещества. Это уравнение можно представить в виде поверхности в пространстве координат p—v—Ty так же, как это было сделано в случае идеального газа (рис. 10.7).
Отрезки в двухфазной области на поверхности уравнения состояния являются прямыми линиями в пространстве, они параллельны оси объема v и ортогональны осям давления р и температуры Т.

Рис. 10.7. Фрагмент поверхности уравнения состояния чистого вещества Если пересечь поверхность уравнения состояния плоскостями, параллельными осям v и Т (изобарами), и спроектировать линии пересечения на плоскость Т— v, получится семейство изобар для уравнения состояния (рис. 10.8).
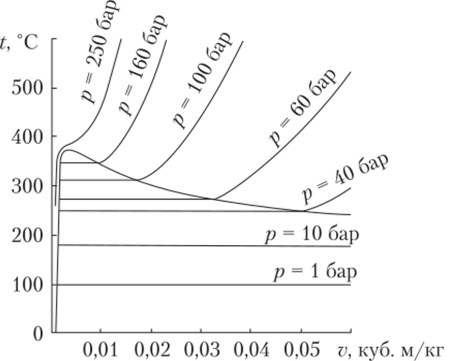
Аналогичным образом можно получить семейство изохор (рис. 10.9). К — критическая точка. Линии над 0—К относятся к жидкому состоянию, линии под этой кривой — к газообразному.
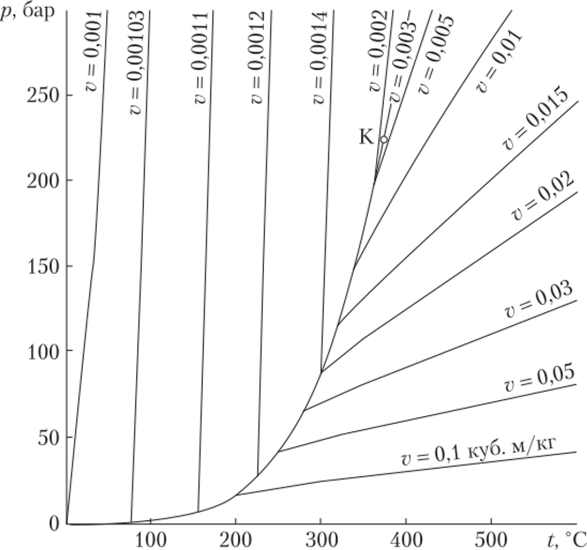
Рис. 10.9. Семейство изохор на р— Т диаграмме воды Область двухфазных состояний ограничена линиями насыщенной жидкости и насыщенного пара, эти линии вместе образуют бинодаль. За пределами этой линии вещество находится в однофазном состоянии. Процессы испарения и конденсации протекают при постоянстве давления и температуры, поэтому в области под бинодалью давление и температура взаимосвязаны: если известно давление, можно определить температуру, а если задана температура, можно найти давление. Однако объем системы в процессах испарения — конденсации меняется. Как известно, состояние простой системы характеризуется значениями двух параметров, поэтому для описания точки в двухфазной области приходится вводить еще один параметр, степень сухости х:
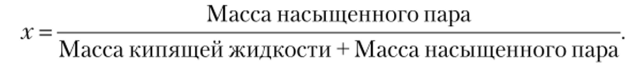
В справочной литературе параметры воды на линии насыщения обозначаются штрихом ('), а параметры водяного пара на линии насыщения — двумя штрихами («). Таким образом,.
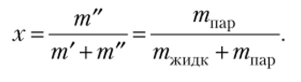
Как нетрудно видеть, степень сухости характеризует массовую долю пара в системе жидкость — пар. В англоязычной литературе этот параметр называется quality (качество), что вполне соответствует его физическому смыслу, поскольку с точки зрения теплоэнергетики степень сухости действительно характеризует качество парожидкостной системы.
Для кипящей жидкости на левой границе двухфазной области т" = О, поэтому степень сухости в этой точке равна нулю. На правой границе вся жидкость испарилась, поэтому т' = 0, а степень сухости равна единице.
Объем влажного пара в двухфазной области равен сумме объемов кипящей жидкости m’v' и насыщенного пара m"v" ,
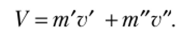
Удельный объем парожидкостной системы (влажного пара) v= V/ (т' + т"),
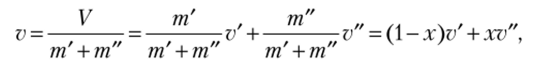
или.
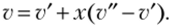
На рис. 10.10 пунктиром обозначены линии одинаковой степени сухости воды в координатах p—v.
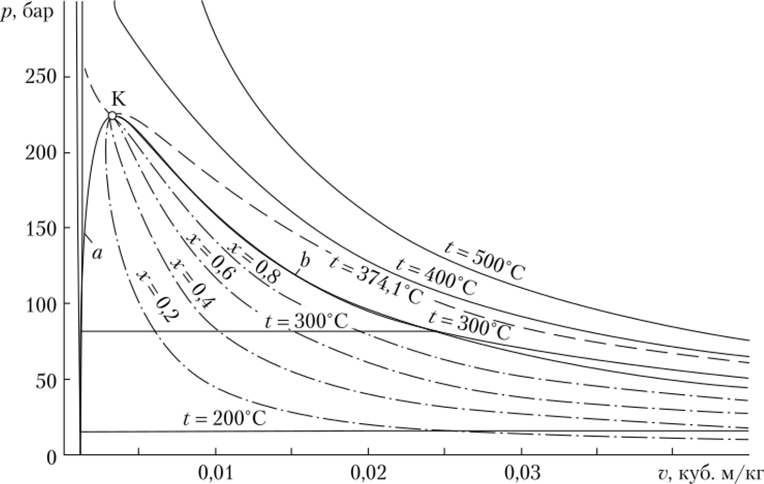
Рис. 10.10. Линии одинаковой степени сухости (пунктир) на p—v диаграмме воды Рассмотрим изохорное изменение состояния жидкости при нагреве в автоклаве (рис. 10.11).
При нагреве жидкости вдоль линии ah (объем меньше критического) в автоклаве наблюдается увеличение жидкой фазы, при этом в точке b все вещество переходит в жидкое состояние. Если нагрев проводить вдоль линии 1—2 (объем больше критического), то с повышением температуры и давления объем жидкой фазы будет убывать, а на линии насыщенного пара жидкая фаза исчезнет. Наконец, если нагрев жидкости осуществляется при v = vKJ то жидкая фаза будет присутствовать в автоклаве почти до критической точки. В критической точке пар становится непрозрачным, наблюдается критическая опалесценция. При дальнейшем нагреве пар вновь становится прозрачным.
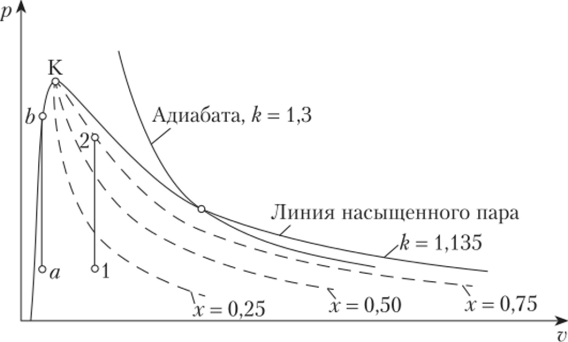
Рис. 10.11. Изохорный нагрев жидкости в автоклаве, пунктиром показаны линии постоянной степени сухости.
На рис. 10.12 изображено несколько экспериментальных изобар водяного пара в координатах (pv/T)—T. Этот рисунок дает представление о степени влияния давления на свойства пара и характеризует отклонение свойств пара от модели идеального газа. Поскольку уравнение состояния газа в общем случае можно записать в виде pv = zRTy где z — фактор сжимаемости, изотермы на данном графике фактически изображены в координатах zR—Ty R = 462 ДжДкг-К).
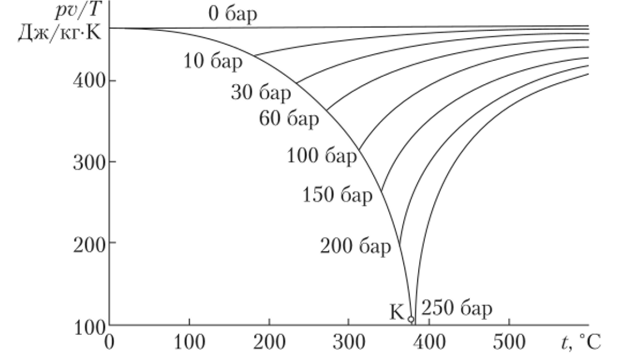
Из экспериментов известно, что при давлении около 20 бар отклонение величины z от единицы для воздуха и водяного пара не превышает 1%. С уменьшением давления z стремится к единице, что соответствует модели идеального газа.
При высоких давлениях, особенно в окрестности точки конденсации, отклонение z от единицы возрастает, причем в зависимости от температуры z может быть как больше, так и меньше единицы.
Мы рассмотрели области существования жидкой и газовой фаз. Рассмотрим теперь область твердой фазы и фазовый переход жидкость — твердое.
Как известно, при давлении 1 атм = 1,1 325 бар вода замерзает при 0 °C. Поскольку объем воды при замерзании возрастает, повышая давление, можно препятствовать расширению воды, тем самым понижая температуру замерзания. И, наоборот, понижая давление, можно повысить температуру замерзания. В частности, при давлении 0,6 112 бар вода замерзает при 0,01°С. Это состояние воды, в котором жидкость, вода и лед находятся в равновесии, называется тройной точкой. Строго говоря, это состояние изображается точкой лишь на р—Т диаграмме. В координатах р—v и T—v равенство трех фаз изображается тройной линией. В тройной точке температура и давление определены однозначно. Напомним, что состояние критической точки определено значениями трех параметров.
Две фазы, например, пар — жидкость, жидкость — лед, могут сосуществовать в некотором диапазоне температур и давлений. Эта область параметров, которая соответствует двухфазной области, на р—Т диаграмме изображается линией (рис. 10.13).
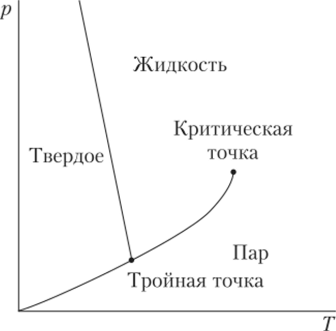
Рис. 10.13. Фазовая диаграмма воды в координатах р—Т.
На рис. 10.13 область пара отделена от области жидкости линией насыщенного пара, область жидкости отделена от области льда линией плавления, область льда от области пара — линией сублимации. Каждая линия характеризует двухфазное равновесие.
Зависимость температуры плавления воды от давления является аномальной. Как правило, фазовая диаграмма вещества в координатах р—Т выглядит так, как показано на рис. 10.14.
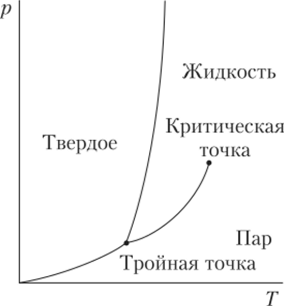
Рис. 10.14. Фазовая диаграмма вещества в координатахр—Т.
Термодинамическая поверхность чистого вещества показана на рис. 10.15. Как было сказано выше, все чистые вещества ведут себя примерно одинаково, взаимосвязь параметров всех чистых веществ также примерно одинакова, однако каждое вещество характеризуется своим положением граничных линий на термодинамической поверхности. На рис. 10.15 изображены однофазные и двухфазные области, а также их границы. Двухфазная область жидкость — пар расположена под критической точкой и ограничена линиями насыщенной жидкости и насыщенного пара. Область существования твердое — газ ограничена тройной линией, линиями сублимации и десублимации. Область существования твердое — жидкость ограничена линиями плавления и затвердевания. Вдоль тройной линии имеет место равновесие трех фаз: твердое — жидкость — пар. Проекция поверхности термического уравнения состояния на плоскость давление — объем показана на рис. 10.16.
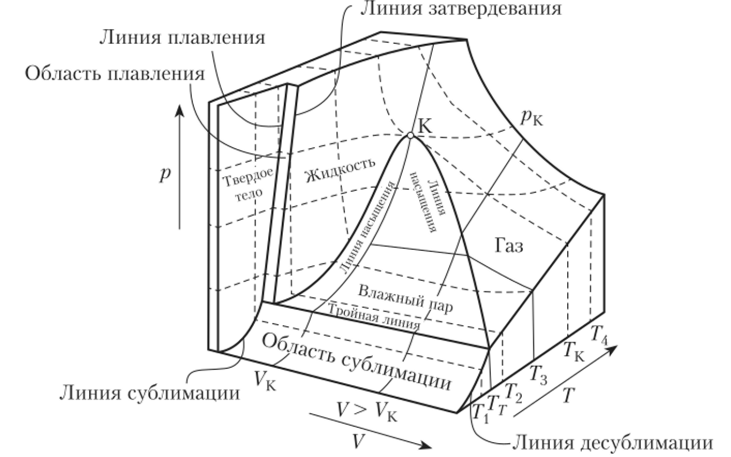
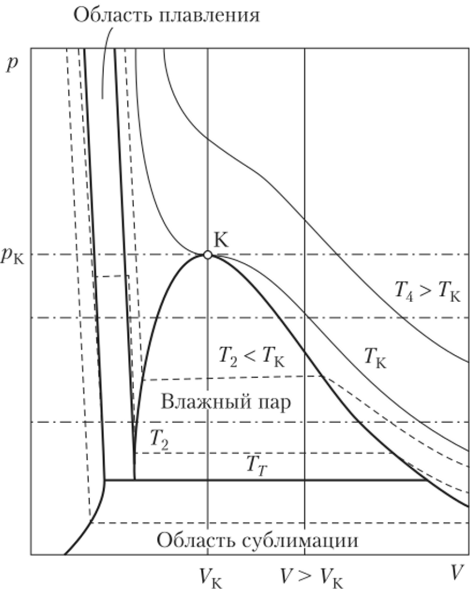
Рис. 10.16. Проекция поверхности термического уравнения состояния на плоскость давление — объем.
Вода ведет себя аномально по сравнению с другими чистыми веществами, поэтому плотность льда меньше плотности жидкой воды. Удельный объем льда больше, чем удельный объем воды. Результатом такого аномального поведения воды в окрестности температуры замерзания является то, что лед всплывает, находится над водой. Еще одна аномалия льда связана с тем, что при повышении давления температура плавления льда понижается. В частности, при давлении 200 МПа лед плавится при температуре около -20°С.
Существование различных агрегатных состояний вещества можно объяснить с точки зрения молекулярной физики. Между молекулами действуют силы притяжения и отталкивания. В зависимости от того, как соотносятся потенциальная энергия взаимодействия молекул и их кинетическая энергия, вещество находится в твердом, жидком или газообразном состоянии (рис. 10.17). Конденсированная фаза характеризуется упорядоченным расположением молекул, которые колеблются в узлах кристаллической решетки. Потенциальная энергия взаимодействия существенно превышает кинетическую энергию частиц. При нагреве вещества его внутренняя энергия возрастает, а вместе с ней растет кинетическая энергия частиц, постепенно энергии движения и взаимодействия становятся сопоставимыми по величине, молекулы покидают узлы решетки и могут перемещаться относительно свободно. Вещество переходит в жидкое состояние. Дальний порядок в структуре вещества частично утрачивается, но ближний порядок сохраняется. При нагреве жидкости, которая находится при температуре кипения, происходит интенсивное испарение, сопровождающееся резким увеличением расстояния между частицами. Их кинетическая энергия становится существенно больше потенциальной. Таким образом, энергия, подводимая к системе в форме теплоты, затрачивается на разрыв связей между частицами и увеличение их кинетической энергии.

Рис. 10.17. Взаимное расположение частиц в зависимости от агрегатного.
состояния вещества:
а — вещество имеет структуру кристаллической решетки; 6 — вещество находится в жидком состоянии; в — вещество находится в газообразном состоянии.
Зависимость температуры кипения вещества от давления широко используется на практике. Пусть у нас есть закрытая банка с жидким фреоном 134а при комнатной температуре (25°С). Если медленно открыть банку, фреон начнет испаряться, давление в банке упадет и станет равным атмосферному. Если держать банку в руках, можно ощутить, что она охлаждается. Поместив в банку термометр, можно измерить температуру фреона, она окажется равной температуре кипения фреона при атмосферном давлении, —26°С. Эта температура будет оставаться неизменной до тех пор, пока весь фреон не испарится.
Понижение температуры обусловлено тем, что часть внутренней энергии вещества затрачивается на испарение жидкости, т. е. энергия от системы отводится с потоком испаренного вещества быстрее, чем энергия подводится к системе за счет теплообмена.
Другой важный аспект этого эксперимента заключается в том, что скорость испарения фреона зависит от скорости подвода тепловой энергии к системе. Теплота испарения фреона 134а при атмосферном давлении составляет 217 кДж/кг. Поэтому, чем быстрее к системе подводится тепловая энергия, тем быстрее испаряется фреон. В предельном случае, когда емкость теплоизолирована, фреон будет оставаться при температуре -2б°С сколь угодно долго.
Температура кипения азота при атмосферном давлении равна -19б°С. Поэтому температура жидкого азота в теплоизолированном сосуде (сосуд Дьюара) составляет -19б°С.
Практичный способ охлаждения овощей с листвой основан на создании вакуума в закрытом контейнере. Для охлаждения давление в контейнере понижается так, чтобы обеспечить требуемую температуру за счет испарения части воды из охлаждаемых продуктов. Испарение происходит за счет тепловой энергии, которая отбирается от влажных частей охлаждаемых продуктов.
При 0 °C давление насыщенных паров воды равно 0,61 кПа, поэтому, если понизить давление в контейнере до этой величины, можно охладить продукты до 0 °C. Очевидно, если понизить давление в контейнере еще больше, то температура также понизится. Следует отметить, что температура понижается не мгновенно, а постепенно, по мере испарения жидкости.
Процедура вакуумного охлаждения включает две стадии. На первой стадии продукты загружаются в камеру при комнатной температуре, камера закрывается и воздух из нее откачивается. Температура в камере не меняется до тех пор, пока не будет достигнуто давление насыщенного пара при температуре 25 °C, которое равно 3,17 кПа. На второй стадии происходит охлаждение, которое сопровождается понижением давления (рис. 10.18).
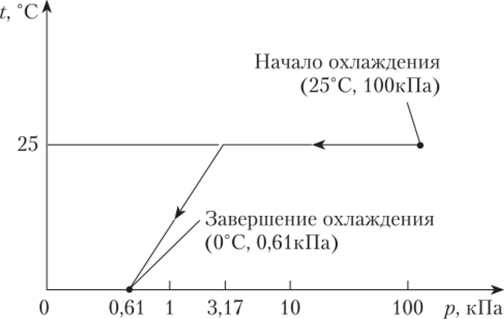
Рис. 10.18. Зависимость температуры в контейнере от давления Вакуумное охлаждение не очень эффективно. Тем не менее процесс охлаждения происходит достаточно быстро. Необходимым условием такого способа охлаждения является наличие влаги в охлаждаемом объеме.
Идея охлаждения за счет вакуума была реализована в 1775 г. В. Калленом для получения льда.
Пример 10.1.
Вода кипит в кастрюле на огне мри атмосферном давлении. За 20 мин уровень воды падает на 2 см. Определите тепловой поток к кастрюле. Диаметр кастрюли 25 см, удельная энтальпия испарения воды при 100 °C Диспй (100°С) равна 2257 кДж/кг, удельный объем воды v' равен 0,001 м3/кг.
Решение
Масса испарившейся воды равна.
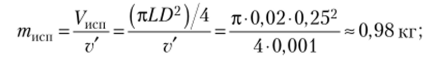
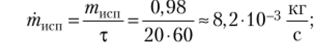
тепловой поток —.