Степень и константа диссоциации.
Электролиты сильные и слабые

Рассчитывая степень диссоциации в процентах, в числитель формул (7.1) и (7.2) необходимо ввести сомножитель 100: Слабые электролиты — электролиты, степень диссоциации которых в разбавленных растворах меньше 3% (0,03). Величину, а можно выразить и через молярную концентрацию растворенного вещества (с): Константа диссоциации выражается формулами (они равнозначны или равноценны): Процесс диссоциации… Читать ещё >
Степень и константа диссоциации. Электролиты сильные и слабые (реферат, курсовая, диплом, контрольная)
Степень электролитической диссоциации
Электролитическая диссоциация имеет определенные количественные характеристики, которыми являются степень электролитической диссоциации (для сильных электролитов — коэффициент активности) и константа диссоциации. Рассмотрим их.
Степень электролитической диссоциации а — отношение числа молекул, распавшихся на ионы /Vpacn, к общему числу молекул растворенного вещества.

Величину а можно выразить и через молярную концентрацию растворенного вещества (с): 
Рассчитывая степень диссоциации в процентах, в числитель формул (7.1) и (7.2) необходимо ввести сомножитель 100:

Слабые электролиты. Константа электролитической диссоциации
По степени диссоциации электролиты подразделяют на слабые и сильные.
Слабые электролиты — электролиты, степень диссоциации которых в разбавленных растворах меньше 3% (0,03).
Диссоциация слабых электролитов является обратимъш процессом, поэтому к нему применимы все законы химической кинетики, в частности закон действующих масс и принцип Ле Шателье по смещению равновесия.
Электролитическую диссоциацию слабого электролита количественно характеризуют константой диссоциации Кя.
Константа диссоциации — отношение произведения молярных концентраций ионов, образовавшихся при диссоциации растворенного вещества, в степенях, равных коэффициентам в уравнении диссоциации, к молярной концентрации непродиссоциировавших молекул слабого электролита. Условно считают, что процесс диссоциации является простой реакцией.
Запишем выражение константы для диссоциации уксусной кислоты: 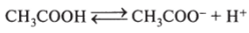
Константа диссоциации выражается формулами (они равнозначны или равноценны):
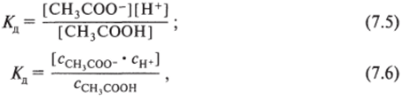
где сн* и [Н+] — молярные концентрации Н+ (разное, но равноценное обозначение), для других частиц (СН3СОО~, СН3СООН) — аналогично.
Константа и степень диссоциации взаимосвязаны друг с другом. Для бинарного электролита (образован двумя ионами; HCN при диссоциации образует два иона: Н+ и CN") эта зависимость выражается законом разбавления Оствальда:

Если, а очень мала, то (1 — а) — 1, тогда  откуда.
откуда.

Процесс диссоциации слабого электролита можно либо усилить, либо подавить.
Для усиления диссоциации необходимо:
- 1. Увеличить температуру раствора.
- 2. Уменьшить концентрацию соли.
- 3. Удалить один из продуктов диссоциации из сферы реакции, что достигается введением иона, связывающего один из ионов, например:
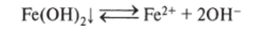
В результате введения Н+ диссоциация Fe (OH)2 усиливается, что обнаруживается растворением осадка этого вещества.
Для подавления диссоциации необходимо:
1. Ввести в раствор одноименные ионы. Так, при диссоциации гидроксида аммония такими ионами являются катионы аммония NHJ, вводимые за счет растворения хлорида аммония (или другой соли аммония):

Введение
катионов аммония усиливает процесс молизации и тормозит процесс диссоциации гидроксида аммония; ослабление диссоциации этого основания обнаруживают, наблюдая ослабление малиновой окраски фенолфталеина после добавления к раствору аммиака, содержащего фенолфталеин, хлорида аммония (или другой соли аммония).
- 2. Увеличить концентрацию растворенного вещества.
- 3. Уменьшить температуру раствора.