Диссоциация воды.
Водородный и гидроксидный показатели

Где и [ОН") — равновесные молярные концентрации (активности) ионов Н+ и ОН"; pH — водородный показатель; рОН — гидроксидный показатель. Степень диссоциации слабого электролита можно рассчитать по формуле (7.20) (преобразованная формула закона разбавления Оствальда): Поясните, что характеризует ионное произведение воды с точки зрения наличия в водных растворах ионов водорода и гидроксида… Читать ещё >
Диссоциация воды. Водородный и гидроксидный показатели (реферат, курсовая, диплом, контрольная)
Вода — слабый электролит. Ее диссоциация является обратимым процессом: 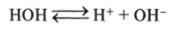
точнее, это уравнение имеет вид.
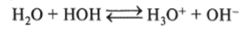
В целях упрощения используют первое уравнение. Количественно процесс диссоциации воды для стандартных условий характеризуется ионным произведением воды, которое выражают или в алгебраической (7.11), или логарифмической (7.12) формах: 
где [Н+] и [ОН") — равновесные молярные концентрации (активности) ионов Н+ и ОН"; pH — водородный показатель; рОН — гидроксидный показатель.
Величины pH и рОН можно рассчитать по формулам.

где lg о (Н+) и lg а (ОН') — десятичный логарифм активной концентрации ионов Н+ и ОН" соответственно. Преобразовав уравнения (7.13) и (7.14), получим уравнения, используя которые рассчитывают активные концентрации ионов Н+ и ОН" :

Активные концентрации этих ионов можно рассчитать и по формулам, полученным из формулы (7.11):

считая при этом, что молярные концентрации ионов равны их активностям, т. е. а (Н+) = [Н+] (для ОН" аналогично).
Общую концентрацию ионов Н+ рассчитывают по формуле.

Степень диссоциации слабого электролита можно рассчитать по формуле (7.20) (преобразованная формула закона разбавления Оствальда):

Ионное произведение воды показывает, что в любом водном растворе содержатся ионы Н+ и ОН". В нейтральном растворе их концентрации одинаковы и для стандартных условий составляют 10″ 7 моль/л; в кислой среде с (Н+) больше с (ОН~), например 10″ 3 — 10″5 моль/л; в щелочной среде с (Н+) меньше с (ОН"), например 10~9, 10″12 моль/л, и т. д. Расчет pH показывает, что в нейтральной среде он равен 7, в кислой — меньше 7, а в щелочной — больше 7.
Реакция среды имеет большое значение в природных процессах, в том числе и экологических. Характер процессов обмена веществ в организмах зависит от pH среды. Так, фермент слюны птиалин расщепляет крахмал в щелочной среде, а белки способны перевариваться в желудке только в кислой среде. Изменение pH на доли единицы делает невозможным реализацию тех или иных процессов. Подкисление почвенной жидкости в почве, на которой выращивают томаты, приводит к их угнетению, а то и к гибели. Кислотные дожди приносят вред растениям и животным ит. д.
- ? Задания для самостоятельной работы
- 1. Поясните, что такое ионное произведение воды; напишите формулы для разной характеристики ионного произведения воды.
- 2. Поясните, что характеризует ионное произведение воды с точки зрения наличия в водных растворах ионов водорода и гидроксида.
- 3. Поясните сущность терминов «водородный показатель», «гидроксидный показатель», что они характеризуют и какое практическое значение они имеют.
- 4. Рассчитайте pH раствора гидроксида натрия, если молярная концентрация щелочи составляет 0,0001 моль/л, а коэффициент активности — 1. Ответ: 10.
- 5. Установлено, что при pH 5,5 продукт считается высококачественным. Измерение концентрации ионов ОН- показало, что она составляет 0,0001. Поясните, можно ли употреблять его в пищу; ответ обоснуйте.