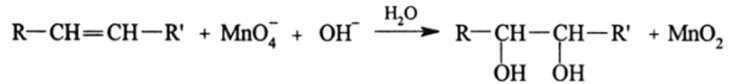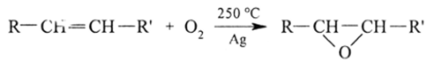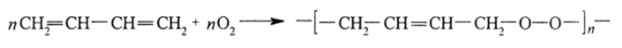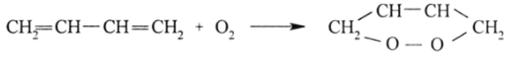Простая 71-связь способна насыщаться не только в рассмотренных выше реакциях, не имеющих ярко выраженной окислительно-восстановительной природы, но и в окислительно-восстановительных процессах.
Присоединение водорода к я-связям алкенов, алкинов и других ненасыщенных углеводородов до сих пор относят к реакциям восстановления. Однако ранее было показано, что гидрирование ненасыщенных углеводородов не изменяет степени окисления атома углерода и атома водорода и не может быть отнесено к реакциям окисления—восстановления.
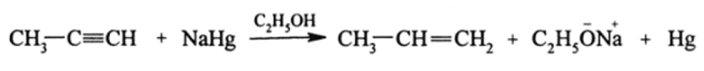
Алкены не способны присоединять активный водород, выделяемый при действии кислот на активные металлы. Лишь алкины могут таким путем присоединить два атома водорода:
Гидрирование алкенов идет с большим трудом. Эффективно только каталитическое гидрирование на Pt, Pd, Ru или Ni при 150—250 °С. Г идрирование ненасыщенных углеводородов само по себе особого практического значения не имеет. В промышленном масштабе гидрируют некоторые производные углеводородов.
Механизмы главных типов реакций окисления и восстановления достаточно подробно рассмотрены в первом разделе. Здесь важно перечислить реакции, имеющие большой практический интерес. Реакции присоединения элементов оксида водорода 2НО к я-связям используются для переработки алкенов до гликолей: 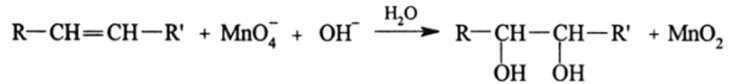
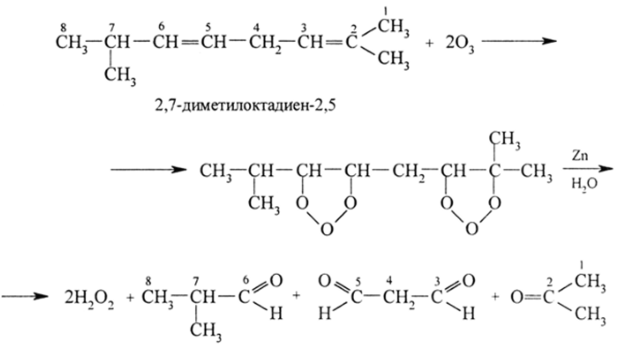
Озонолиз. приводящий к окислительному расщеплению л-связи любой природы (простой, сопряженной, ароматической), позволяет точно установить по характеру образующихся молекул положение л-связи:
Одна из реакций окисления алкенов с помощью Ag20 (каталитическое окисление кислородом воздуха в присутствии Ag) или надкислот RC03H широко используется в лакокрасочной промышленности для синтеза алкеноксидов (так называемых эпоксидов) — трехчленных циклических простых эфиров: 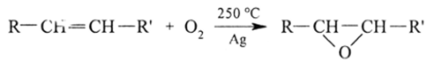
Эти простые эфиры гликолей используются для синтеза растворителей и реагентов, когда они вступают в реакцию с ROH, RCOOH, NH3, H2S, HSR, гликолями и т. д.
Весьма своеобразно в реакциях окисления кислородом ведут себя сопряженные диены. Молекулярный кислород может инициировать образование перекисей полимеров, например:
а также давать циклические перекиси: