Химические свойства.
Органическая химия в 2 ч. Часть 2

Из этих данных следует, что основные свойства аминов зависят не только от электронной плотности на атоме азота (доказано, что у (CH3)3N она выше, чем у первичного и вторичного амина, и следовательно, в газовой фазе третичный амин имеет по сравнению с ними более сильные основные свойства), но и от сольватации алкилзамещенных. Так, сольватация катионов в водном растворе убывает в ряду NH* > RNH3… Читать ещё >
Химические свойства. Органическая химия в 2 ч. Часть 2 (реферат, курсовая, диплом, контрольная)
Эти свойства аминов определяются в основном двумя реакционными центрами (РЦ) — свободной 2у2-парой электронов и полярной связью N-H, способной к реакциям замещения. У ароматических аминов уменьшается роль первого РЦ вследствие mr-сопряжения аминогруппы с бензольным ядром, в результате чего изменяется валентное состояние атома азота с р до sp2, и сильно возрастает роль третьего РЦ — углеводородного остатка. Реакции расщепления C-N-связей для аминов мало характерны.
Протонирование и комплексообразование аминов — их главные реакции. Первичные алкиламины как основания в 20 раз сильнее NH3. Это следует из значений констант основности (Кь):
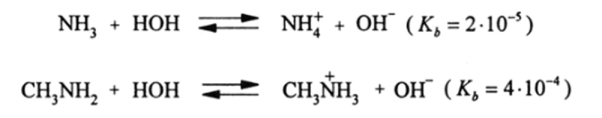
Усиление основности связано с донорными свойствами алкилов (+/- эффект), т. е. с большой электроотрицательностью азота по сравнению с углеродом. Эффект от введения второй алкильной группы уже мало ощутим (Кь-5*10-4), тогда как третий алкил сильно понижает основные свойства атома азота. Кь у (СН3)зЫ в водном растворе составляет 510″ 5, т. е. близка к NH3.
Из этих данных следует, что основные свойства аминов зависят не только от электронной плотности на атоме азота (доказано, что у (CH3)3N она выше, чем у первичного и вторичного амина, и следовательно, в газовой фазе третичный амин имеет по сравнению с ними более сильные основные свойства), но и от сольватации алкилзамещенных. Так, сольватация катионов в водном растворе убывает в ряду NH* > RNH3 > RjNHJ > R3NH+ >
> R4N*. Следовательно, алкилирование аммиака с ростом числа алкилов препятствует сольватации из-за отсутствия у R сродства к воде и экранирования главного центра сольватации N* алкильными группами.
Замещение атомов водорода в NH3 на ареновые остатки сильно понижает основные свойства уже на первой стадии. Так, у анилина /l4 = 310~10, т. е. на 5 порядков меньше, чем у NH3. Поэтому анилин протонируется до фениламмония и дает соли только с сильными кислотами:
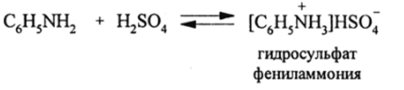
При разбавлении раствора анилина с концентрированной H2S04 водой равновесие смещается влево и анилин освобождается.
Введение
второго фенила в NH3 понижает основность более, чем на 4 порядка. У дифениламина Kb = 7−10″ 14. Он дает соли только с моногидратом серной кислоты. Трифениламин солей вообще не образует, а вступает с H2S04 в реакцию ассоциации:

Фснильные кольца являются акцепторами электронной пары азота за счет wc-сопряжения с ней. В результате электронный заряд (плотность) на атоме азота сильно понижается, а в орто- и шрд-положениях фенильного остатка сильно возрастает. Поэтому аминогруппы в нейтральной, щелочной и слабокислой среде являются орто-пара-ориентантами и чрезвычайно сильно активируют бензольное ядро к электрофильным реагентам. В сильно.
+ ?
кислой среде образуютсяNH3, -NH2—, которые являются уже электронными акцепторами, сильно дезактивируя бензольное ядро, аналогично N02— группе.
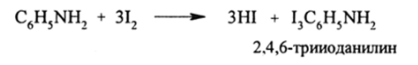
В нейтральной среде галогенирование идет стремительно, даже с 12 без всяких катализаторов:
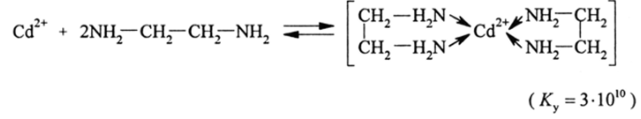
Алкиламины с водными растворами солей-элементов образуют прочные комплексы, причем даже с таким крупным катионом, как кадмий:
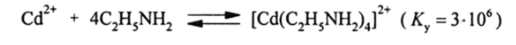
Вследствие хелатного эффекта особенно прочные комплексы образуют диамины, триамины и тетрамины. Так, например:
Ароматические амины — слабые лиганды и их комплексы с солями металлов мало устойчивы.
Реакции алкилирования аминов. Алкиламины являются сильными нуклеофилами и легко взаимодействуют с R-Г (Г = I", ВГ, СГ) по механизму SN2 или SN1 и образуют замещенные соли аммония и амины высшего порядка:
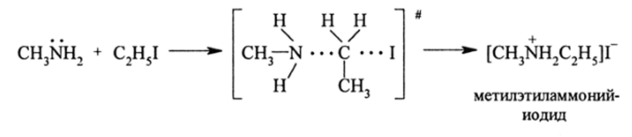
При этом один из электронов с азота уходит к атому иода и происходит ионизация реагентов. Если имеется избыток первичного амина, то в системе появляется вторичный амин:

Вторичные амины алкилируются аналогичным образом до третичных, а третичные до тетраалкиламмониевых солей (четвертичных солей):

Алкиламмониевые соли любой степени алкилирования с AgOH образу;
?? ?
ют гидроксиды алкиламмония [RNH3]OH, [R2NH2]OH, [R3NH]OH и.
? ~.
[R4N]OH такие же неустойчивые, как NH4OH. Из этих гидроксидов наиболее устойчивы [R4NJOH, которые по силе основных свойств приравниваются к щелочам.
Ароматические амины — слабые нуклеофилы и с RT не алкилируются в таких мягких условиях, как алкиламин. Промышленный способ алкилирования спиртами проходит при нагревании их гидросульфатов под давлением:
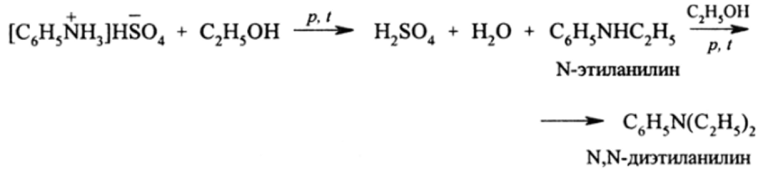
Возможно провести алкилирование свободного анилина спиртами над А1203. Алкили диалкиланилины — очень технически важные вещества. Они применяются для синтеза азокрасителей, трифенилметановых красителей, как ангидетонаторы топлива, для изготовления взрывчатых веществ (тротил) и т. д.
Следует отметить одну особенность третичных ариламинов. Трифениламин не способен с RГ образовывать четвертичные соли аммония, например
[(С6Н5), Й (СН3)]Г Реакции ацилирования аминов. Эти реакции связаны с замещением Н-атомов в NH2— иNH — группах на ацилрадикалы кислот R-COи Аг-СО-. Ацилирование аминов легко проходит с хлорангидридами и ангидридами кислот:
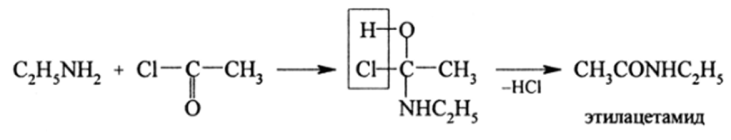
Эти реакции приводят к алкиламидам. Ариламиды кислот, кроме указанного способа, получают еще перегонкой смеси ароматических аминов и карбоновых кислот:
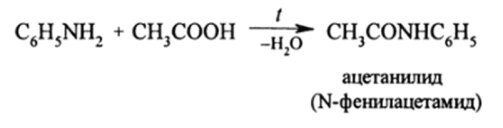
Фенилам иды карбоновых кислот называются анилидами. В отличие от анилина анилиды, как очень устойчивые к окислению соединения, можно нитровать и сульфировать. После проведения этих реакций гидролизом в кислой или щелочной среде можно из анилидов (и ацилал кил аминов) вновь получать амин и кислоту:

Реакции с HN02. Особенно своеобразно протекают эти реакции у первичных ароматических аминов и являются для них главными. Здесь наблюдается большое различие в свойствах алкиламинов и ариламинов. Первичные алкиламины с HN02 превращаются в спирты:
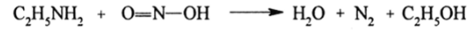
Вторичные алкиламины с HN02 образуют нитрозоамины:
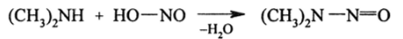
Нитрозоамины — жидкости желтого цвета. Следовательно, —N=0;
группировка является слабым хромофором. Нитрозоамины нерастворимы в воде, с крепкой водной НС1 гидролизуются до амина и HN02.
Третичные алкиламины с HN02 не реагируют. Таким образом, реакция с HN02 может служить качественной реакцией на алкиламины и использоваться для разделения третичных, вторичных и первичных аминов.
Ароматические первичные амины с HN02 образуют устойчивые на холоду (0—5 °С) диазосоединения:
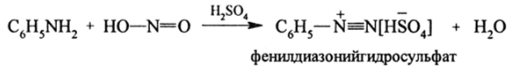
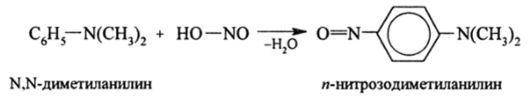
Третичные ариламины с HN02 образуют нитрозосоединения:
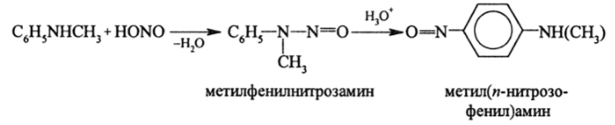
Вторичные ариламины с HN02 сначала образуют нитрозамины, которые в кислой среде изомеризуются в амины нитрозобензола:
Реакции окисления аминов. Алкиламины устойчивы к окислителям. На них действуют лишь сильные окислители. Так, третичные алкиламины окисляются Н202 до аминоксидов:
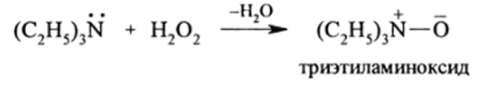
При этом атом азота передает один электрон на орбитали кислорода, а второй образует с ним ст-связь. Такая ионно-ковалентная связь называется семиполярной (полу полярной).
В отличие от алкиламинов аромаппсские амины очень легко окисляются даже кислородом воздуха. Поэтому на воздухе они темнеют, являясь в чистом виде бесцветными продуктами. Реакции окисления ариламинов обычно очень сложны. Так, анилин окисляется дихроматом в кислой среде до анилинового черного. Он образуется непосредственно на волокне, если его пропитать водным раствором К2Сг207 или К2СЮ4, а затем обработать солянокислым анилином.
Анилиновый черный представляет из себя смесь многих сложных молекул, поглощающую свет по всему спектру, что создает сплошное поглощение в видимой области и черный цвет. Один из компонентов, выделенный из анилинового черного, имеет строение хромофорной цепи, в которой чередуются диаминовые и хинонаминовые структуры:

Анилиновый черный красит хлопок и шелк как протравной краситель с солями Сг3 Для окраски меха в черный цвет вместо него используется краситель, полученный окислением и-фенилендиамина NHy—NH2
или /i-аминофенола NH2——ОН с Н:02, Н2СЮ4 или Си2+.
Дифениламин окисляется HN03 или HN02 до красителя дифенилбензидина:
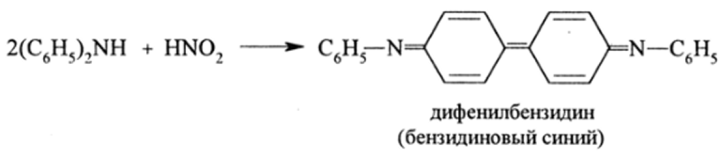
Его образование — хорошая качественная реакция на нитраты и нитриты, которая широко используется в экологии для контроля за содержанием NO,' и NO,'.
Следует отметить, что окисление анилина дихроматом в сернокислом растворе дает п-бензохинон:
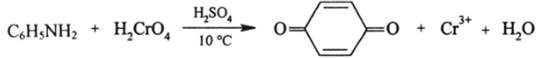
Другие реакции аминов. Из других реакций наиболее важна реакция образования изонитрилов (карбиламинов), которая имеет место при нагревании первичных апкиламинов с СНС13 в щелочной среде:
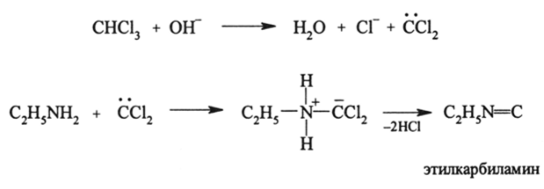
Карбиламины изомерны нитрилам. Реакция их образования является качественной на первичные алкиламины.
Изонитрилы являются примером соединений с углеродом в низком валентном состоянии. Считают, что их структура R—N=C. Однако она мало вероятна. Карбиламины имеют отвратительный запах, они ядовиты.
Реакция ариламинов с альдегидами и кетонами, ведущая к азометинам (шиффовым основаниям), была рассмотрена ранее.
Очень важной является способность ортодиаминов бензола и аренов при нагревании с HN02, RCOOH, дикетонами и другими подходящими соединениями замыкаться в гетероциклы:
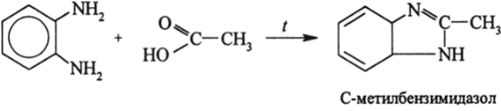
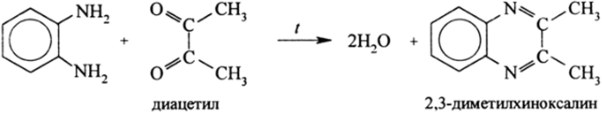
При этом образуются азотистые ароматические гетероциклы. Реакции метафенилендиамина с фталимидом и его производными приводят к сопряженным азотистым макроциклам, которые образуются в результате реакции конденсации:
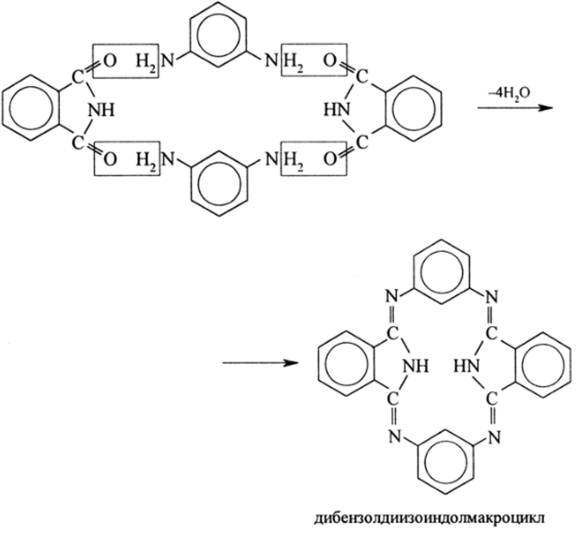
Азотистые макроциклы, состоящие из двух изоиндольных остатков и двух аренов, соединенных между собой азамостиками, относятся к сопряженным макроциклам, в которых бензольные л-системы изолированы, автономны, так как они выходят из плоскости изоиндольных остатков.