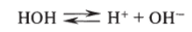Вода — слабый электролит. Ее диссоциация обратима:
В стандартных условиях (Т = 298 К, р = 101,3 кПа) диссоциация воды количественно характеризуется ионным произведением воды, которое выражают или в алгебраической (1.1), или логарифмической (1.2) формах:
где [Н+] и [ОН-] — равновесные молярные концентрации (активности) ионов Н+ и ОН-; pH — водородный показатель; рОН — гидроксидный показатель.
Водородный показатель pH (пэ аш) — отрицательный десятичный логарифм активной концентрации катионов водорода:

Гидроксидный показатель рОН (пэ о аш) — отрицательный десятичный логарифм активной концентрации ионов гидроксида ОН-. Математически рОН можно рассчитать по формуле.
где lgo (H+) и lga (OH-) — десятичный логарифм активной концентрации ионов Н+ и ОН- (соответственно). Преобразовав уравнения (1.3) и (1.4), получим уравнения, используя которые можно рассчитать активные концентрации ионов Н+ и ОН-:
Активные концентрации этих ионов можно рассчитать и по формулам, полученным из (1.4):
считая при этом, что молярные концентрации ионов равны их активностям, т. е. а (Н+) = [Н+] (для ОН- аналогично).
Общую концентрацию ионов Н+ рассчитывают по формуле 
Степень диссоциации слабого электролита можно рассчитать по формуле.
где с — молярная концентрация; ад — степень электролитической диссоциации; Кл — константа диссоциации (сведения об этих величинах находят в справочниках).
Ионное произведение воды показывает, что в любом водном растворе содержатся ионы Н+ и ОН-. В нейтральном растворе их концентрации одинаковы и для стандартных условий составляют 10-7 моль/л; в кислой среде с (Н+) больше с (ОН-), например 10-3—10-5 моль/л; в щелочной среде с (Н+) меньше с (ОН-), например 10-9— Ю-12 моль/л и т. д.
Расчет pH показывает, что в нейтральной среде он равен 7, в кислой — меньше 7, а в щелочной — больше 7. Следовательно, для нейтральной среды pH = 7; для кислой pH 7. Реакция среды имеет большое значение для протекания процессов, характерных для строительства. Например, процессы схватывания цемента оптимально протекают в сильнощелочной среде (pH > 12). В слабощелочной среде резко усиливается коррозия стальной арматуры. Кислотные дожди вызывают разрушение зданий и памятников искусства, изготовленных из карбоната кальция (известняка, мрамора и др.).
Задания для самостоятельной работы
- 1. Поясните, что такое реакция среды, и назовите показатели, которые определяют ее характер.
- 2. Поясните, почему любой водный раствор одновременно содержит ионы Н+ и ОН-.
- 3. Рассчитайте pH раствора, если концентрация гидроксида натрия составляет 0,0001 моль/л, степень диссоциации щелочи — 100%(1). Ответ: pH = 10.
- 4. Поясните, какова роль реакции среды в строительной индустрии (на двух обоснованных примерах).