Концепция химического резонанса как способ описания сопряженных молекул в методе ВС

Где двухсторонняя стрелка символизирует «явление» резонанса. Очевидно, что обе структуры имеют одинаковое право на существование, т. е. они «входят» в реальную структуру СН3СОО" с одинаковым (по 50%) весом. Тогда очевидно, что каждая связь С-0 будет образована тремя электронами, парой а-электронов и одним 71- электроном. Связь будет иметь нецелочисленный порядок связи (п.с. = 1,5). Заряд… Читать ещё >
Концепция химического резонанса как способ описания сопряженных молекул в методе ВС (реферат, курсовая, диплом, контрольная)
В 40-х годах нашего столетия выдающийся американский химик Л. Полинг применил квантово-механическую идею делокализации электронов к молекулам, имеющим три и более сопряженных р.-электрона (точнее р.-орбигалей) на соседних атомах. Такая сопряженная л-система имеется у приведенных выше ацетат-иона, изопрена, бензола и бесконечного числа других молекул. Согласно этой идее в непрерывной цепи л-электронов, например, в углеродной цепи.

а также в цепи, включающей кроме л-электронов примыкающие к ним р.-элсктронные пары или же пустые (без электронов) низколежатцие орбитали.
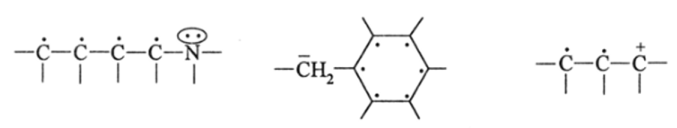
р;-электроны, а также частично р.-электронные пары делокализуются в процессе спаривания и могут более или менее свободно перемещаться по цепи сопряженных атомов под действием электрического, магнитного или электромагнитного поля. Однако для структурно-химического воплощения идеи делокализации электронов в молекулах с л—яили гт-сопряжением Полинг выдвинул, как впоследствии оказалось, не самый удачный способ, названный им химическим резонансом канонических структур.
В этом методе распределение я-электронов в реальной сопряженной молекуле или любой молекулярной частице (молекула, ион, радикал, ион-радикал) описывается с помощью наложения двух или большего числа (у сложных молекул десятков и сотен) «крайних», так называемых канонических, структур друг на друга. Так, эквивалентность связей С-0 в ацетат-ионе правильно отражается наложением двух канонических структур (I) и (И), которые, как предполагал Полинг, «резонируют» друг с другом, т. е. переходят друг в друга с неизмеримо высокой скоростью:
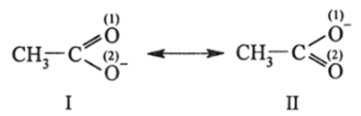
где двухсторонняя стрелка символизирует «явление» резонанса. Очевидно, что обе структуры имеют одинаковое право на существование, т. е. они «входят» в реальную структуру СН3СОО" с одинаковым (по 50%) весом. Тогда очевидно, что каждая связь С-0 будет образована тремя электронами, парой а-электронов и одним 71- электроном. Связь будет иметь нецелочисленный порядок связи (п.с. = 1,5). Заряд (-) будет равномерно распределен между двумя атомами кислорода. Поэтому реальная структура изображается как структура III:
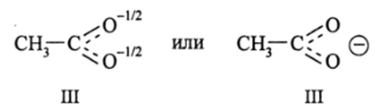
Однако структура (ИГ) уже не имеет отношения к химическому резонансу.
В методе резонанса предполагается, что за счет «резонанса» канонических структур энергия понижается.
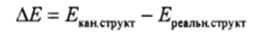
и эту разность энергий Полинг назвал «энергией резонанса».
Для описания реального электронного состояния связей С-С в бензоле Полинг сначала предложил две канонические структуры (структуры Кекуле):
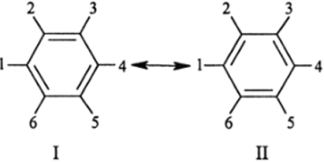
которые, входя в реальную молекулу с одинаковым весом (50%) дают структуру, отражающую эквивалентность (по длине, прочности и всем другим свойствам) всех химических связей бензола.
Вполне очевидно, что без привлечения идеи резонанса эту структуру можно записать, как IV.
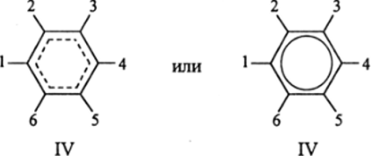
которые обе (разная форма записи одной и той же сущности) полностью отражают идею полной делокализации шестерки л-электронов бензола и дают возможность оценить порядок связи С—С, как равный 1,5. Однако главная цель, которую преследовала теория резонанса, связанная с объяснением всех известных, но еще не объясненных фактов, касающихся сопряженных молекул, состояла в том, чтобы придумывать все новые и новые резонансные структуры, доводя их число до неразумно больших значении. Это привело к безудержному формализму теории, который принимал все более уродливые формы. Поэтому для бензола были предложены структуры Д. Дьюара (V—VII), ионные резонансные структуры (VIII, IX и X):
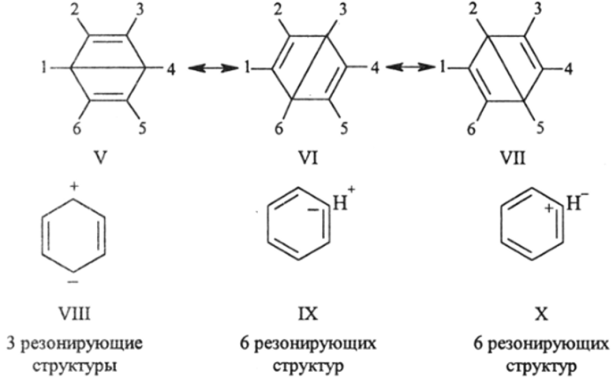
Предполагалось, что структуры V—X вв.ходят в реальную структуру молекулы бензола с небольшим весом, который может возрастать у производных бензола. Тем не менее уже для бензола имеется 20 структур. Можно брать любой набор структур и объяснять любое свойство. Удобная ситуация для «знатока» метода резонанса лишена всякого познавательного значения для начинающего изучать химию.
Так, было известно, что в производных бензола, содержащих оили л-электронодонорную группу (ЭД), электрофильный реагент (HN03, H2S04, С12 и т. д.) замещает преимущественно соседние Н-атомы (орто-положения) и противоположный атом водорода (пара-положение) и очень в малой степени два других Н-атома (мета- положение):
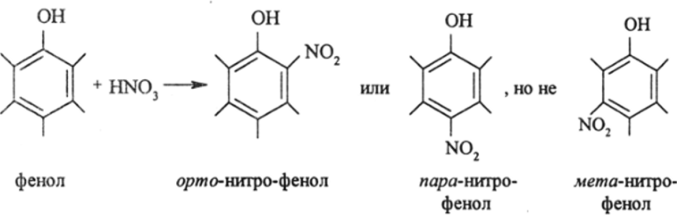
HN03 — электрофильный реагент (ЭФР), который активно атакует такие атомы молекулы, на которых электронная плотность повышена (5-) в сравнении с незамещенным бензолом. Исходя из этого известного факта, можно написать распределение электронной плотности в молекуле фенола и указать места успешной атаки электрофильного реагента, реакционный центр которого имеет избыточный отрицательный заряд:
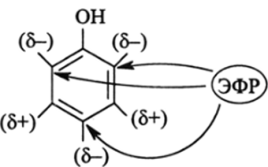
Теория резонанса объяснила распределение электронной плотности с помощью резонансных ионных структур. Атом кислорода ОНгруппы имеет л-электронную пару, которая вступает во взаимодействие с л-системой бензола (лл-сопряжение). Полинг привел три ионных резонансных структуры:
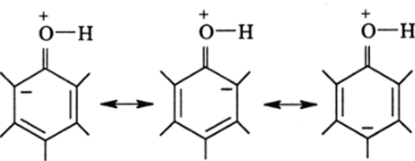
из которых следует, что отрицательный заряд, возникший за счет перехода целого электронного заряда от атома кислорода к атомам углерода, локализуется в орто- и л ара-положениях к гидроксильной группе. Поскольку классическую структурную формулу с отрицательным зарядом в мета-положениях нельзя записать, как спинспаренную, то по Полингу появление электронного заряда в л<�е/иа-положении невозможно:
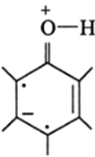
Неизвестно, почему из резонансных структур исключаются свободно-радикальные. По-видимому, в методе химического резонанса отбираются только такие структуры, которые нужны для объяснения, и исключаются все те, которые не нужны.
Теперь рассмотрим сущность химического резонанса и его происхождение. Может ли существовать химический резонанс? Известно, что существует механический резонанс, как явление передачи колебательной энергии от одного колеблющегося маятника к другому, если они колеблются с одинаковой частотой и амплитудой и подвешены на одной планке.
Аналогично происходит интерференция волн различного происхождения — электромагнитных, акустических и гидродинамических.
Однако не может быть передачи и сложения энергии у несуществующих материальных объектов. Канонические резонансные структуры являются мысленными, а не реальными образами, а сам резонанс — это только математический способ описания электронной структуры сопряженной молекулы с помощью подходящих валентных схем. Большинство резонансных структур, в том числе биполярные ионные структуры, не могут возникнуть даже в условиях оптического возбуждения, когда поглощается энергия в сотни кДж/моль.
Поэтому говорить о резонансе, как явлении, и об энергии резонанса, как реальном процессе понижения энергии (стабилизации молекулы), недопустимо. К сожалению, сам автор теории Полинг с целью придать большее значение детищу своей фантазии допускал трактовку химического резонанса и энергии резонанса как реально существующих явлений.
На смену химическому резонансу пришли новые теории — в том числе одна из самых предсказательных и жизнестойких — теория молекулярных орбиталей.