Применение d-металлов и их соединений

Еще одно применение циркония связано с его способностью сгорать в кислороде воздуха (температура самовоспламенения 250°С) практически без выделения дыма, с высокой скоростью и развивая наиболее высокую температуру из всех металлических горючих (4650°С). За счет высокой температуры образующаяся двуокись циркония излучает значительное количество света, что используется очень широко в пиротехнике… Читать ещё >
Применение d-металлов и их соединений (реферат, курсовая, диплом, контрольная)
Практические применения ?/-металлов рассмотрим в последовательности возрастания их порядковых номеров в периодической таблице.
Скандий. Мировое производство металлического скандия составляет 2—10 т/год. Россия имеет богатые рудные источники скандия. Современный способ получения скандия — восстановление его оксида металлическим кальцием:
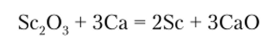
Главным, но объему применением металлического скандия является его использование в алюминиево-скандиевых сплавах (содержание скандия от 0,3%), применяемых в спортивной экипировке. Порядка 80 кг скандия (в виде оксида) в год используется для производства осветительных элементов высокой интенсивности. Иодид скандия добавляется в ртутно-газовые лампы, производящие очень правдоподобные источники искусственного света, близкого к солнечному, которые обеспечивают хорошую цветопередачу при съемке на телекамеру. Значительный интерес для авиакосмической и атомной техники имеют тугоплавкие интерметаллические соединения скандия с рением (температура плавления — до 2575°С).
Титан. В настоящее время мировое производство металлического титана достигает 100 тыс. т/год. Свойства металлического титана существенно зависят от его чистоты. Только в 1925 г. голландские ученые ван Аркель и де Бур нашли способ получения титана с чистотой 99,9%, который и проявляет замечательные свойства — легкость, прочность, ковкость, стойкость к коррозии. Россия обладает вторыми в мире, после Китая, запасами титана. Минерально-сырьевую базу титана России составляют 20 месторождений. Самое крупное из разведанных месторождений (Ярегское) находится в Республике Коми. Запасы месторождения оцениваются в 2 млрд т руды со средним содержанием диоксида титана около 10%.
Современный способ получения титана состоит из нескольких стадий. Сначала исходную руду (оксид титана рутил ТЮ2) с помощью хлора (в присутствии углерода) при нагревании переводят в четыреххлористый титан: 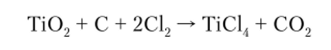
Четыреххлористый титан в обычных условиях представляет собой жидкость с температурой кипения 136 °C.
Тетрахлорид титана был впервые получен французским химиком Ж. Б. А. Дюма еще в 1826 г. Довольно быстро он нашел неожиданное практическое применение, связанное с тем, что он способен интенсивно образовывать маскирующие дымовые завесы. Это свойство Т1С14 объясняется тем, что при попадании в атмосферу пары тетрахлорида титана гидролизуются парами воды, всегда присутствующими в воздухе:
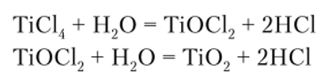
В результате получается взвесь титан ил хлорида и диоксида титана, которая и образует плотное дымообразное облако. Учитывая то, что это облако насыщено хлористым водородом, образующим капли тумана соляной кислоты, именно в качестве боевого дымообразователя и использовался ТЮ14 в Первую мировую войну.
Далее Т1С14 подвергается металлотермии (магнием или натрием):
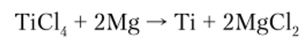
Эта реакция идет в стальных реакторах при температуре 900 °C. В результате образуется так называемая титановая губка, пропитанная магнием и хлоридом магния. Их испаряют в герметичном вакуумном аппарате при температуре 950 °C, а титановую губку затем спекают или переплавляют в компактный металл. Это основной промышленный метод.
Для получения более чистого титана и поныне используется иодидный метод, предложенный ван Аркелем и де Буром. Металлотермический губчатый титан превращают в йодид ТП4, который затем возгоняют в вакууме. На своем пути пары иодида титана встречают раскаленную до 1400 °C титановую проволоку. При этом иодид разлагается, и на проволоке нарастает слой чистого титана. Этот метод получения титана малопроизводителен и дорог, поэтому в промышленности применяется ограниченно.
Металлический титан — основа высокопрочных сплавов для авиации, судостроения и ракетной техники. Вторым важнейшим потребителем титана является металлургия. Он входит в состав сотен марок сталей и сплавов. В нержавеющие стали его вводят для предотвращения межкристаллитной коррозии. В жаростойких высокохромистых сплавах он уменьшает размер зерна, делая структуру металла однородной и мелкокристаллической. В других жаростойких сплавах титан — упрочняющий элемент.
Из титана вес чаще изготовливают многие авиационные узлы и детали — от двигателя до болтов и гаек. По мнению американских специалистов, только в результате замены стальных болтов двигателя титановыми в одном из типов истребителя вес двигателя снижается чуть ли не на сто килограммов. Так как каждый из этих сбереженных килограммов уменьшает вес самолета на 10 кг (благодаря облегчению фюзеляжа), общая экономия в весе достигнет тонны. По прогнозам специалистов, в ближайшие годы доля конструкций из титана и его сплавов в самолетах, скорость которых в 2—3 раза выше скорости звука, возрастет до 60—90%. Не обходится без него и космическая техника. Отличные эксплуатационные качества присущи, в частности, титановым бакам для хранения жидкого кислорода и водорода: при сверхнизких температурах титан не разрушается, как большинство металлов, а, наоборот, становится еще прочнее (источник: Венецкий С. О редких и рассеянных. Рассказы о металлах. М.: Металлургия, 1981. иЯЬ: http://allforchildren.ru/rasrnet/me5.php).
Одно из замечательных свойств титана — его необычная стойкость к коррозии. Именно благодаря стойкости к атмосферной коррозии титан используется для создания конструкций, которые должны существовать века, — таковы, например, памятники Покорителям космоса и Юрию Гагарину в Москве.
Ванадий. Мировое потребление металлического ванадия составляет около 60 тыс. т/год и очень быстро растет (на долю России приходится порядка 60% мировых запасов ванадия). Ванадий чистотой 99,8% получают путем восстановления оксида ванадия (У) металлическим кальцием:
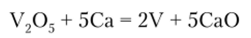
В чистом виде ванадий применяется редко. Сплавы ванадия легче растворяются в металлах, чем чистый ванадий, и плавятся при более низкой температуре. Эти две особенности используются в черной металлургии. Для легирования чугуна и стали обычно применяют феррованадий — сплав ванадия с железом. Черная металлургия потребляет до 95% производимого металлического ванадия. Он используется как легирующая добавка к стали, чугуну, титановым сплавам. Ванадий резко повышает твердость, ковкость, износоустойчивость, жаропрочность и коррозионную стойкость сплавов. Взаимодействуя с растворенным в стали и чугуне углеродом ванадий образует тугоплавкий (?пл = 2800°С) карбид:
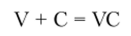
Карбид ванадия образует твердую фазу и распределяется в расплаве в виде огромного числа тонкодисперсных включений, которые препятствуют росту зерен железа при кристаллизации расплава. Это способствует образованию мелкокристаллической структуры металла.
Г. Форду приписывается фраза: «Если бы не было ванадия — не было бы автомобиля». Добавка доли процента ванадия делает сталь мелкозернистой. Такая сталь легче переносит удар и изгиб, упорнее сопротивляется истиранию, лучше противостоит разрыву. Вот почему такие ответственные узлы и детали автомобиля, как двигатель, клапанные пружины, рессоры, оси, валы, шестерни, изготовляют из ванадиевой стали.
Хром. Мировое потребление металлического хрома составляет около 25 тыс. т/год. Совершенно чистый (без газовых примесей и углерода) хром довольно вязок, ковок и тягуч. При? малейшем загрязнении углеродом, водородом, азотом и т. д. становится хрупким, ломким и твердым. Это, однако, не мешает многим практическим областям применения хрома, а потому значительные его количества получают алюмотермическим способом. Полученный таким способом металл используется для производства феррохрома (сплав, содержащий до 60% хрома)!
Именно в форме феррохрома в сплавы и вводится хром — один из самых важных легирующих элементов, применяемых в черной металлургии. Хром в небольших количествах придает сталям твердость и прочность. Из хромсодержащих сталей изготавливают лопатки газовых турбин и детали реактивных двигателей. При значительных содержаниях хрома в сталях (12% и более) они приобретают значительную коррозионную стойкость и становятся особым конструкционным материалом — нержавеющими сталями.
Часто коррозионная стойкость гомогенных твердых растворов менее устойчивого металла, легированного более устойчивым, изменяется не непрерывно, а скачками. Резкое изменение коррозионной стойкости происходит при концентрации легирующего элемента в 1/8 атомной доли или кратной этому числу величине. Такая закономерность получила название «правило п/8 Таммана». Это явление может быть обусловлено образованием в кристаллической решетке твердых растворов упорядоченного расположения атомов примеси, что приводит к возникновению в кристаллах «защитных плоскостей» легирующего компонента. Таково одно из объяснений пассивирующего действия хрома, поскольку обогащенная хромом поверхность железа в результате воздействия окружающей среды покрывается защитной пленкой оксида хрома.
Чистый электролитический хром используется для нанесения металлических покрытий в электронике. Тонкие пленки из хрома наносят на жесткие диски компьютеров, индикаторные панели телевизоров и жидкокристаллические дисплеи. Хром применяется и как износоустойчивый и красивый материал для гальванических антикоррозионных и декоративных покрытий. Такой процесс называете я хромированием.
Марганец. Мировое производство марганца составляет 7—7,5 млн т/год. Около 90% всего производимого марганца потребляется для изготовления легированных сталей. Поэтому из руд обычно выплавляют не чистый марганец, а высокопроцентный сплав Мп с железом и углеродом — ферромарганец (70—95% Мп). Выплавку его из смеси марганцевых и железных руд ведут в электрических печах. Восстановитель — кокс:
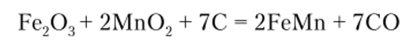
Более чистый металлический марганец получают восстановлением его прокаленных оксидов алюминием. Марганец повышает износостойкость стали и предел прочности на разрыв. Он заменяет дефицитный никель при выплавке нержавеющих сталей. Марганец обычно вводят в сталь вместе с другими элементами — хромом, кремнием, вольфрамом. Однако есть сталь, в состав которой, кроме железа, марганца и углерода, ничего не входит. Это так называемая сталь Гадфилда. Она содержит 1 — 1,5% углерода и 11 — 15% марганца. Сталь этой марки обладает огромной износостойкостью и твердостью. Ее применяют для изготовления дробилок, которые перемалывают самые твердые породы, деталей экскаваторов и бульдозеров. Твердость этой стали такова, что она не поддается механической обработке, детали из нее можно только отливать.
Высокочистый металлический марганец получают электролизом раствора его сульфата МпБ04. Современный вариант этого способа разработан советским электрохимиком Рафаэлем Ильичем Агладзе (1911 — 1983). Полученный таким образом металл используется в электронике для создания перспективных полупроводников (МпСа25е4 и др.).
Цирконий, ниобий, молибден. Мировое потребление чистых металлов (без учета их ферросплавов и других продуктов) для металлического циркония составляет 4—5 тыс. т/год, металлического молибдена — около 17 тыс. т/год, металлического ниобия — 450 т/год. Эти три элемента роднят не только их свойства, но и то, что они в металлической форме производятс я для нужд самых высокотехнологических отраслей — атомной, аэрокосмической и электронной.
Кроме этих элементов в последнее время достаточно широкое распространение получил и технеций, искусственный элемент, получаемый в ядерных реакторах. Общемировое производство технеция составляет несколько тонн в год. Все его изотопы радиоактивны с различными периодами полураспада. Практически используются 97Тс (Т½ = 2,6 млн лет), 98Тс (Т½= 1,5 млн лет), «Тс (Т½ = = 2,12 млн лет) и «» Тс (Т½ = 6 ч). В мире проведено десятки миллионов процедур диагностики гастритов с использованием изотопа «тТс. Более стабильные изотопы технеция используются как наилучшие ингибиторы коррозии сталей (пассивирующее действие пертехнатов — солей, содержащих анион ТсО^, — проявляется уже при их концентрациях в 0,5%).
Цирконий имеет очень малое сечение захвата тепловых нейтронов. Поэтому металлический цирконий, не содержащий гафния, и его сплавы применяются в атомной энергетике для изготовления тепловыделяющих элементов, теплообменников и других конструкций ядерных реакторов.
Цирконий — единственный редкий металл, мировое потребление которого в форме соединений исчисляется сотнями тысяч тонн. Более 85% производимого циркониевого сырья используется в минеральной форме в виде циркона, содержащего 65—66% Zr02. Цирконовый концентрат (98—99% циркона) широко применяется в производстве строительной и сантехнической керамики, огнеупоров, литейном производстве. Около 10% циркона подвергается переработке для получения диоксида циркония и различных его соединений, 5% приходится на металл и сплавы. Диоксид циркония широко используется при получении высокоогнеупорных изделий, жаростойких эмалей, тугоплавких стекол, различных видов керамики, керамических пигментов, твердых электролитов, термозащитных покрытий, катализаторов, искусственных драгоценных камней, режущих инструментов и абразивных материалов. В последние годы диоксид циркония начал широко применяться в волоконной оптике и производстве керамики, используемой в электронике (источник: www.zirconium.ru/articles/18).
Еще одно применение циркония связано с его способностью сгорать в кислороде воздуха (температура самовоспламенения 250°С) практически без выделения дыма, с высокой скоростью и развивая наиболее высокую температуру из всех металлических горючих (4650°С). За счет высокой температуры образующаяся двуокись циркония излучает значительное количество света, что используется очень широко в пиротехнике (производство салютов и фейерверков), производстве химических источников света, применяемых в различных областях деятельности человека (факелы, осветительные ракеты, осветительные бомбы, ФОТАБ — фотоавиабомбы). В этой сфере повышенный интерес имеет не только металлический цирконий, но и его сплавы с церием (значительно больший световой поток). Порошкообразный цирконий применяют в смеси с окислителями как бездымное средство в сигнальных запалах (источник: Получение нанопорошков диоксида циркония / А. В. Жуков [и др.) // Успехи в химии и химической технологии. 2013. Т. XXVII. № 6. ШШ http://acct.muctr.ru/mcdia/ аИткэ/рб^О 1327_146033−037.pdf).
Добавка ниобия (в виде сплава феррониобия) к специальным сортам стали резко повышает устойчивость сварных швов из этих сталей. Стали, содержащие от 1 до 5% ниобия, отличаются исключительной жаростойкостью и применяются для устройства котлов высокого давления и реактивных двигателей. Мировое потребление феррониобия составляет около.
30 тыс. т/год. Из чистого ниобия изготовляются детали электрических конденсаторов и «горячая» арматура (аноды, катоды, сетки) электронных (для радарных установок) и мощных генераторных ламп. Более 75% молибдена применяют для легирования жаростойких и жаропрочных сталей, используемых в авиакосмической индустрии, энерготурбинах, автостроении. Молибденовая проволока (лента) служит для изготовления высокотемпературных печей, вводов электрического тока в лампочках. Молибден также используется для легирования урана.
Металлический уран при сплавлении с 2% молибдена и быстрой закалке разогретого до 850 °C металла в воде или масле становится тверже и прочнее стали (прочность на разрыв больше 1600 МПа, притом что у чистого урана она равна 450 МПа). В сочетании с большой плотностью (19,05 г/см3) это делает закаленную урановую болванку чрезвычайно эффективным средством для пробивания брони.
Обедненный уран вследствие его огромной плотности (почти вдвое тяжелее свинца) используется для радиационной защиты и как балластная масса в аэрокосмических применениях, таких как рулевые поверхности летательных аппаратов. В каждом самолете «Боинг-747» содержится 1500 кг обедненного урана для этих целей. Кроме того, этот материал применяется в высокоскоростных роторах гироскопов, больших маховиках, как балласт в космических спускаемых аппаратах и гоночных яхтах, болидах «Формулы-1», при бурении нефтяных скважин (источники: American Free Press. 2004. 25 октября. URL: http://nuclcarno.ru/ tcxt. asp?9378; http://ru.wikipcdiaorg/wiki/ypaH_(элемент)).
Гафний, тантал, вольфрам, рений. Мировое потребление чистых металлов (без учета их ферросплавов и других продуктов) для металлического гафния составляет около 50 т/год, металлического тантала — около 1400 т/год, металлического вольфрама — около 2000 т/год, металлического рения — около 40 т/год. Это группа тяжелых тугоплавких металлов. Среди них вольфрам — первый по тугоплавкости (tm = 3410°С).
Сегодня больше 90% гафния потребляет ядериая энергетика для производства регулирующих стержней атомных реакторов.
Гафний — очень близкий химический аналог циркония и в природе всегда сопутствует ему. По у чистого циркония сечение захвата тепловых нейтронов равно 0,18 барна, а у чистого гафния — 120 барп (у изотопа 174Hf оно составляет 1500 барп!). И первоначально гафний являлся отходом производства циркония «реакторной чистоты».
Из тантала изготавливают теплообменники, нагреватели, тигли для вакуумной плавки металлов. Его применяют при изготовлении электролитических конденсаторов и ответственных деталей электронных приборов (до 30% потребления металлического тантала). Благодаря хорошей биосовместимости с живыми тканями человека тантал используют для костного протезирования.
Танталовыс конденсаторы благодаря уникальным свойствам содержащегося в них металла имеют максимальную удельную емкость при минимальных габаритах, отличаются очень высокой надежностью в работе в широком диапазоне температур и большим сроком службы (свыше 12 лет). Они изготавливаются из порошка чистого тантала. Размер частиц составляет около 10 мкм.
Важнейшее применение вольфрама — быстрорежущие стали (17,5— 18,5% W) и сплавы. Среди них — «победит», очень твердый сплав, содержащий 80—87% вольфрама, 6—15% кобальта, 5—7% углерода. Он широко востребован при обработке металлов, в горной и нефтедобывающей промышленности. Из вольфрамовой стали и других сплавов, содержащих вольфрам или его карбиды, изготовляют танковую броню, оболочки торпед и снарядов, наиболее важные детали самолетов и двигателей. Основой при производстве инструментальных и жаропрочных сплавов является ферровольфрам (68—86% У, до 7% Мо и железо). В форме ферровольфрама используется около 90—95% всего вольфрама.
Вольфрам из-за его тугоплавкости и низкого давления пара при высоких температурах является незаменимым для нитей накала электроламп, а также для деталей электровакуумных приборов в радиои рентгенотехнике. Незаменимость вольфрама в этой области объясняется не только его тугоплавкостью, но и пластичностью. Из одного килограмма вольфрама вытягивается проволока длиной 3,5 км, т. е. этого килограмма достаточно для изготовления нитей накаливания 23 тыс. 60-ваттных лампочек. Именно благодаря этому свойству мировая электротехническая промышленность потребляет всего около 100 т вольфрама в год. Чистый вольфрам используется для противовесов, бронебойных сердечников подкалиберных и стреловидных оперенных снарядов артиллерийских орудий, сердечников бронебойных пуль и сверхскоростных роторов гироскопов для стабилизации полета баллистических ракет (до 180 тыс. об/мин). Перспективным является использование вольфрама для защиты от ионизирующих излучений при работе с аппаратурой дистанционной медицинской гамма-терапии, проверки качества сварных швов, сканеров пограничного контроля и в других случаях, когда его свойства как конструкционного материала (твердость и химическая стойкость) обеспечивают ему преимущества по сравнению со свинцом и обедненным ураном (источник: http://www.tungsten-alloy.com/ ги551апДип§ 51еп-гасйаЧоп-51'пе1(1п^-0 l. htm).
Рений как очень редкий и дорогой металл используется в виде сплавов п соединений: платино-рениевых катализаторов для синтеза высококачественного бензина, вольфрам-рениевых термопар, позволяющих измерять температуры до 2200 °C, сплавов с вольфрамом и молибденом. Рений весьма важен для приборостроения: из ренийсодержащих сплавов делают, в частности, керны измерительных приборов высших классов точности (керн — это опора, на которой вращается рамка прибора). Материалы для кернов должны быть немагнитны, коррозионностойки, тверды. И еще они должны как можно медленнее изнашиваться в процессе эксплуатации. Таким условиям отвечает многокомпонентный сплав на кобальтовой основе 40-КПХМР, легированный 7% рения. Этот же сплав используют для производства упругих элементов крутильных весов и гироскопических приборов (источник: http://n-t.ru/ri/ps/pb075.htm).
В условиях сырьевой базы России вопрос дефицита рения стоит особенно остро, поскольку производства первичного рения с распадом СССР отошли к союзным государствам (Казахстан, Узбекистан, Армения). И несмотря на то что именно в России находится единственное собственно рениевое месторождение, третье в мире по запасам этого металла, — фумарольные поля вулкана Кудрявый (о. Итуруп Курильской гряды), отечественная промышленность в большой степени зависима от импорта металла. Это связано с отсутствием на сегодняшний день промышленных технологий, позволяющих извлекать рений «из вулкана». Также рений присутствует в горячих парогазовых выбросах из кратера вулкана. Извлечение металла из таких источников является далеко не тривиальной задачей. Предложенные российскими учеными технологии улавливания рения из парогазовых выбросов вулкана пока находятся на стадии пилотных испытаний. В настоящее время производство рения в России ограничено лишь скромными объемами получаемого при переработке вторичного ренийсодержащего сырья металла, по разным оценкам не превышающими 0,5−1,5 т. Выбросы рения с вулканическими газами на Итурупе составляют до 36 т в год, тогда как мировая добыча не превосходит 40 т, а цена 1 кг рения на мировом рынке — от 1 до 4 тыс. долл. Но чтобы добывать рений из газа, на кратере Кудрявого необходимо построить купол размером 800—900 кв. м. Мировых аналогов такой технологии нет (источники: Петрова А. Л/., Катков А. Г. Без рения ракеты не летают // Редкие земли. URL: http://rareearth.ru/ni/pub/20 131 111/ 15. html; Ковачич Е. // ИА REGNIUM. URL: http://www.regnum.ru/news/ innovatio/1 881 255.html#ixzz3QWDQfFKI).
Из рения делают самоочищающиеся электрические контакты. При замыкании и разрыве цепи всегда происходит разряд, в результате чего металл контакта окисляется. Окисляется и рений, но его оксид Re207 летуч при относительно низких температурах (температура кипения — всего 362,4°С) и при разрядах испаряется с поверхности контакта, поэтому рениевые контакты служат очень долго (источник: http:// ru. wikipediaorg/wiki/Рений).
Семейство железа. Мировое потребление чистых металлов семейства железа (без учета их ферросплавов и других продуктов) весьма различно. Так, для чистого железа (так называемое железо прямого восстановления, или армко-железо) оно составляет «всего» около 45 млн т/год из 1,5 млрд т общего объема производства черной металлургии, металлического кобальта — «только» около 54 тыс. т/год, металлического никеля — около.
1,4 млн т/год.
Железо известно с глубокой древности и до сих пор определяет облик нашей технической цивилизации. Впервые человек познакомился с металлами этого семейства через взаимодействие с космическим веществом — метеоритами.
Железо прямого восстановления главным образом используется для получения качественных сталей и сплавов (например, для подшипников) и как необходимый компонент шихты при переплавке металлолома. Из чистого железа изготавливаются сердечники электромагнитов.
Кобальт имеет несколько важных областей применения — для производства суперсплавов, аккумуляторов, постоянных магнитов, катализаторов и в ряде других.
Никель в основном потребляется для производства нержавеющих сталей (дополнительно он упрочняет сталь, повышает ее ударную вязкость и снижает хладноломкость), а также является основой большинства суперсплавов — жаропрочных материалов, применяемых в аэрокосмической промышленности для деталей силовых установок. Кроме того, он широко применяется в производстве железо-никелевых, никель-кадмиевых, никель-цинковых, никель-водородных аккумуляторов.
Никель входит в состав специальных стойких к коррозии сплавов, из которых изготавливается оборудование для извлечения золота цианидным методом. В ходе обработки цианидом натрия золото переходит в раствор при его выщелачивании из бедных золотоносных пород.
В этом случае оно растворяется в растворах цианидов при доступе воздуха, образуя весьма коррозионную среду. Эта реакция, открытая в 1843 г. II. Р. Багратионом (племянником знаменитого полководца П. И. Багратиона), сегодня широко применяется для извлечения золота из руд (источник: http://chemiday.com/reaction/3-l-0−1557).
Семейство платиноидов. В семейство входят шесть «благородных металлов» — рутений[1], родий, палладий, осмий, иридий и платина. Почти всегда в природе они присутствуют совместно в составе «сырой платины». Производство платиновых металлов измеряется в тройских унциях (унция — единица массы в английской системе мер). Тройская унция (тр. у.) равна 31,1 г. Применение всех платиновых металлов прежде всего связано с их каталитическим действием на многие реакции. Например, в производстве азотной и уксусной кислот.
Ярким примером использования каталитических свойств металлов платиновой группы является процесс очистки, или дожигания, выхлопных газов автомобилей. Именно это технологическое применение использует около 60% всей платины, потребляемой промышленностью. По прогнозам экспертов, в ближайшее время ожидается возрастание в сотни раз потребления платины в производстве топливных элементов, где она также используется в качестве катализатора.
Кроме того, платиновые металлы издревле используются в ювелирном производстве, в электронной и химической промышленности. Родий используется как катализатор, а также в производстве ЖК-мониторов, в фильерах для производства стеклонитей.
При этом родий не входит ни в состав стекла, ни в состав люминофоров. Он необходим для придания механической прочности платиновым мешалкам, используемым при производстве сверхчистого стекла для жидкокристаллических мониторов. В связи с очень высокими ценами на чистый родий и при значительном спросе и малом объеме добываемого родия встает актуальная задача выделения его стабильного изотопа из осколков деления ядерного топлива (урана, плутония, тория), где он накапливается в значительных количествах (до 130— 180 г на 1 т осколков) для решения острого дефицита родия. Учитывая развитую атомную энергетику в крупнейших индустриальных странах, можно предполагать, что объем добычи реакторного родия в несколько раз превысит его добычу из руд (источник: http://www.cmmarket.ru/markcts/rhworld.htm).
Осмий расходуется преимущественно на выпуск сверхтвердых специальных сплавов, отличающихся повышенной стойкостью к истиранию (для компасных игл, осей, трущихся частей точных инструментов и, наконец, перьев дорогих ручек).
Семейство меди. Все три металла встречаются в природе в свободном состоянии — медь относительно редко, а золото — как правило. Сегодня медь получается из оксидных и сульфидных руд и руд полиметаллов восстановительной плавкой медных концентратов в электрических, отражательных, шахтных печах с дальнейшей очисткой черновой меди электролизом. На первом (пирометаллургическом) этапе медь переводят в медный штейн (расплав сульфидов) с последующим выжиганием серы кислородом воздуха и получением черновой меди, на втором — из черновой меди отливают аноды, которые затем в процессе электролиза в подкисленном растворе СиБО^ «перегоняют» на катод, оставляя примеси в растворе и шламе.
Структура потребления меди (в %) следующая: строительство — 34 (кровельный материал, водопроводные трубы, сантехническое оборудование и т.н.), электроэнергетика и электронная промышленность — 28, машиностроение — 14 (удорожание энергоносителей окончательно определило первенство меди как более теплопроводного металла в конкурентной борьбе с алюминием при производстве теплообменников, кондиционеров, автомобильных радиаторов и т. п.), транспорт — 12, прочие — 12. Значительные количества меди используются в виде сплавов с оловом (бронзы) и цинком (латуни).
Производство серебра только на четверть осуществляется непосредственно на серебряных рудниках — остальные три четверти металла добываются как побочный продукт вместе со свинцом, цинком и некоторыми другими металлами. Структура потребления серебра (в %): ювелирное дело — 35, фотография — 24, электроника и аккумуляторы — 14. Потребление в фотографии неуклонно сокращается (переход на цифровые камеры), а в электронике и чеканке монет — растет.
До 1970 г. существовала привязка большинства валют к золоту. Цена на золото в это время находилась под жестким контролем и не превышала 35 долл, за тр. у. После устранения привязки цены на золото стали быстро расти. Рост стоимости золота способствует увеличению золотодобычи, потому что низкие цены предыдущих лет делали работу многих золотодобывающих предприятий нерентабельной. Стало выгодно перерабатывать бедные и труднообогатимые руды. В добычу вовлекаются забалансовые запасы, возобновляется добыча на законсервированных предприятиях. Структура потребления золота (в %): ювелирное дело — 67, электроника —.
9,5, зубопротезирование — 1,8, монеты — 1,4. За последние 30 лет потребление золота в электронике возросло почти в пять раз и продолжает расти.
Семейство цинка включает в себя три внешне очень различных металла. Еще до начала нашей эры была известна латунь — сплав меди с цинком, но металлического цинка древние люди не знали. Основное общемировое потребление металлического цинка приходится на цинкование металлических конструкций (около 50%) и получение сплавов (около 40%).
Кроме традиционных латуней и бронз в последнее время появились новые сплавы. К наиболее перспективным из цинковых сплавов следует отнести плоский прокат из титан-цинка. Благодаря высокой коррозионной стойкости, пластичности, экологической чистоте, органолептическим свойствам (устойчивый серый цвет) данный материал широко применяется для изготовления металлических фальцевых кровель и системы водоотвода: труб, желобов и т. п. Только Германия импортирует примерно 65 тыс. т проката из титан-цинка в год, имея собственное производство в объеме около 70 тыс. т. Потребление титан-цинка имеет тенденцию к росту 3—5% в год в связи с ростом жилищного строительства.
Структура потребления кадмия включает в себя производство никелькадмиевых батарей и аккумуляторов, кадмиевых покрытий и легирование меди.
Значительная часть промышленного потребления кадмия приходится на кадмиевые защитные покрытия, предохраняющие металлы от коррозии. Эти покрытия имеют значительное преимущество перед никелевыми, цинковыми или оловянными, так как не отслаиваются от деталей при деформации и особенно стойки в морской воде. Сплавы кадмия с небольшими добавками никеля, меди и серебра используют для изготовления подшипников мощных судовых, авиационных и автомобильных двигателей.
В ювелирном деле используют сплавы золота с кадмием. Изменяя соотношение компонентов, получают различные цветовые оттенки.
Потребление ртути в основном связано с электрохимическими производствами хлора и едкого натра (электролиз растворов №С1 с жидким ртутным катодом) и производством приборов, содержащих ртуть.
В практических применениях часто используется большая плотность ртути (например, в ртутных гироскопах). Ее плотность настолько велика (13,6 г/см3), что ведро со ртутыо обычный человек даже не оторвет от иола, но в ней невозможно и утонуть (рис. 8.4)!

Рис. 8.4. Человек сидит не в ртути, а на ртути.
Источник: http://www.theodoregray.com/PeriodicTable/Elements/080/index.s7.html.
Ртуть — эго единственный жидкий при комнатной температуре металл, она замерзает лишь при сильном морозе. Это было обнаружено лишь в 1736 г. в Иркутске: при сильном морозе «замерзание» термометра наблюдал французский астроном и географ Ж.-Н. Делиль (1688—1768).
Следует отметить, что сама металлическая ртуть не является ядом. Опасность представляют ее пары и растворимые соединения. Однако в связи с тем что Всемирная организация здравоохранения (ВОЗ) рассматривает ртуть в качестве одного из десяти основных химических веществ или групп химических веществ, представляющих значительную проблему для общественного здравоохранения, 9 октября 2013 г. по инициативе ООН была принята Минаматская конвенция по ртути (источник: Ртуть и здоровье // Информационный бюллетень ВОЗ № 361. 2013. Сентябрь. 1ЖЬ: http://www.who.int/mediacentre/factsheets/fs361/ru). В сентябре 2014 г. к ней присоединилась и Россия.
Документ предусматривает поэтапный отказ от использования ртути. К 2018 г. должно будет прекратиться производство ацетальдегида с применением ртути в качестве катализатора. К 2020 г. вводятся ограничения на применение ртути в горнодобывающей промышленности, в том числе при непромышленной добыче золота, а также в производстве цемента.
В число предметов, которые должны быть выведены из пользования, включены барометры и другие измерительные приборы, люминесцентные лампы, аккумуляторы, ртутьсодержащие амальгамы в стоматологии и косметические средства. Также будет прекращено производство таких неэлектронных измерительных приборов, как термометры и приборы для измерения давления. К 2025 г. предполагается остановить хлорно-щелочное производство, при котором применяют ртуть (источник: Минаматская конвенция по ртути. Досье ТАСС. РЖЬ: http://itar-tass.com/info/1 466 535).
Правда, как быть с основным источником промышленного загрязнения окружающей среды — выбросами тепловых электростанций, которые ответственны за 65% техногенного поступления ртути в окружающую среду {источник', федеральный портал http://www.protown.ru/information/hide/ 5599. html), пока неясно.
Как бы то ни было, очевидно, что ртуть «уходит» из цивилизационного обихода. Но это не значит, что наука и техника исключают ее из сферы своего внимания навсегда. Свойства этого элемента настолько богаты и разнообразны, что в будущем ртуть найдет новые области применения. Но, разумеется, с учетом всех требований общественного здравоохранения и экологии.
- [1] Открыт в 1844 г. профессором химии Казанского университета Карлом Карловичем (Карл-Эрнст) Клаусом (1796—1864). Назван первооткрывателем в честь России (от лат. киЖета — Россия). Важно подчеркнуть, что открытие этого элемента именно в России вомногом предопределено тем обстоятельством, что двумя десятилетиями ранее на Урале были разведаны богатейшие залежи самородной платины, и к 1835 г. Россия уже чеканила платиновые монеты (источник: Буслаева Т. М. Платиновые металлы и их роль в современном обществе // Соросовский образовательный журнал. 1999. № 11. Ш1Ь: www.pereplet.ru/nauka/8ого5/рй1У991 l045.pdf).