Электролитическая диссоциация воды.
Ионное произведение воды

Вариации содержания катиона водорода в питьевой воде могут различаться в 100 (США) и даже в 1000 раз (Россия). Для утоления жажды употребляется и более кислая вода. Так, если насытить воду углекислым газом при атмосферном давлении, то pH полученной «газировки» будет равен 3,7. Такую кислотность имеет примерно 0,0007%-ный раствор соляной кислоты, а желудочный сок человека намного кислее (в среднем… Читать ещё >
Электролитическая диссоциация воды. Ионное произведение воды (реферат, курсовая, диплом, контрольная)
Среди слабых электролитов вода занимает особое место. Она растворитель и важнейший элемент природной среды, определивший саму структуру химии и жизни на нашей планете. Вода — один из самых сложных объектов химии. Структурирующие ее водородные связи обладают энергией, которая хотя и не обеспечивает строгой регулярности расположения молекул как в кристаллах, но не допускает и большого термодинамического хаоса. Картина усложняется тем, что вода самопроизвольно диссоциирует на ионы. Они, в свою очередь, вступают во взаимодействие с молекулами воды и их ассоциатами. В итоге все это приводит к тому, что жидкая вода имеет сложную и динамичную структуру.
В последнее время проводятся многочисленные теоретические квантовохимические расчеты возможных структур крупных водных кластеров. Из-за наличия в них большого числа мобильных водородных связей такие кластеры могут обладать удивительными свойствами, среди которых не исключается и свойство служить элементом памяти квантовых компьютеров.
Рассмотрим простейшую модель жидкой воды, состоящей только из отдельных молекул Н20. В этом случае диссоциацию воды можно описать схемой 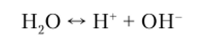
Запишем константу равновесия этого процесса:
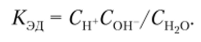
Поскольку степень диссоциации воды чрезвычайно мала, то молярная концентрация воды в воде ^н2о практически неизменна и равна 55,56 моль/л, а потому может быть перенесена в левую часть как константа:
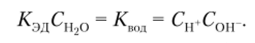
Константа Кшт называется ионным произведением воды. При температуре 25 °C оно равно 10 14 моль2/л2. При увеличении температуры Квод значительно возрастает (табл. 14.4).
Таблица 14.4
Зависимость ионного произведения воды от температуры.
г, °с. | ||||||
А""д' 10м | 0,1139. | 0,5702. | 1,0008. | 1,469. | 5,474. | 9,614. |
Прологарифмируем полученное выражение:
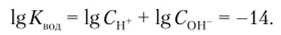
Из уравнения диссоциации воды следует Сн+ = Сон, поэтому для нейтральных растворов можно записать: 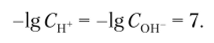
Величина отрицательного десятичного логарифма молярной концентрации катионов водорода называется водородным показателем среды и обозначается pH: 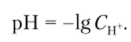
Величина отрицательного десятичного логарифма молярной концентрации анионов гидроксила называется гидроксильным показателем среды и обозначается рОН: 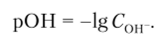
Из сказанного очевидно, что.
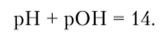
Для нейтральной среды pH = 7, для кислой pH 7.
Подчеркнем, что вода со значением pH = 7 — очень дорогой химический реактив. Обычная вода содержит соли (минерализация) и растворенные газы (особенно влияет на pH содержание углекислого газа). Норматив на питьевую воду предусматривает в довольно широких пределах возможность колебаний pH:
- • в странах ЕС: 6,5—9,5;
- • в США: 6,5−8,5;
- • рекомендация ВОЗ: 6,5—8,5;
- • в России: 6,0—9,0.
Вариации содержания катиона водорода в питьевой воде могут различаться в 100 (США) и даже в 1000 раз (Россия). Для утоления жажды употребляется и более кислая вода. Так, если насытить воду углекислым газом при атмосферном давлении, то pH полученной «газировки» будет равен 3,7. Такую кислотность имеет примерно 0,0007%-ный раствор соляной кислоты, а желудочный сок человека намного кислее (в среднем pH = 1,6). Значения pH некоторых растворов приведены в табл. 14.5.
Таблица 14.5
Значения pH некоторых растворов.
Раствор | pH. | Раствор | pH. |
Электролит в свинцовых аккумуляторах. | < 1,0. | Чай. | 5,5. |
Кислотный дождь. | <5,6. | ||
Желудочный сок. | 1,0−2,0. | Кожа здорового человека. | ^6,5. |
Окончание табл. 14.5
Раствор | pH. | Раствор | pH. |
Кока-кола. | 2,1−2,4. | Слюна. | 6,35−6,85. |
Лимонный сок. | 2,5±0,5. | Молоко. | 6,6−6,9. |
Уксус. | 2,9. | Кровь. | 7,36−7,44. |
Яблочный сок. | 3,5+1,0. | Морская вода. | 8,0. |
Пиво. | 4,5. | Раствор пищевой соды. | 8,5. |
Кофе. | 5,0. | Мыло для рук. | 9,0−10,0. |
Шампунь. | 5,5. | Нашатырный спирт. | 11,5. |
Источник: http://ru.wikipedia.org/wiki/PH.