Литий.
Натрий.
Подгруппа калия

Гидроксиды МеОН — бесцветные гигроскопические вещества, хорошо растворимые в воде с выделением большого количества тепла. В водных растворах МеОН являются самыми сильными основаниями — щелочами (NaOH, КОН, RbOH, CsOH). Из них наибольшее значение в технике имеют гидроксиды натрия (едкий натр или каустическая сода) NaOIi и калия (едкое кали) КОП. Их получают электролизом водных растворов NaCl и КС1. Читать ещё >
Литий. Натрий. Подгруппа калия (реферат, курсовая, диплом, контрольная)
Общая характеристика металлов IA-подгруппы.
Элементы IA-подгруппы (за исключением лития Li) называются щелочными металлами. Это название они получили из-за того, что гидроксиды некоторых из них издавна известны как щелочи. На внешнем электронном уровне их атомов имеется по одному электрону (s1), сильно удаленному от ядра, благодаря чему для них характерны низкие потенциалы ионизации и сильные восстановительные свойства.
Наиболее чувствительным методом качественного определения этих металлов является фотометрия. При внесении в пламя горелки соли щелочного металла она разлагается, и пары освободившегося металла окрашивают пламя в характерный для каждого металла цвет: 
Свойства металлов и некоторые физические константы представлены в табл. 1.1.
Таблица 1.1
Свойства элементов 1А-подгруппы
Свойства. | 3Li. | uNa. | 19К. | 3?Rb. | 55Cs | 87Fr. |
Металлический радиус атома, А. | 1,55. | 1,89. | 2,36. | 2,48. | 2,68. | 2,80. |
Радиус иона Э+, А. | 0,68. | 0,98. | 1,33. | 1,49. | 1,65. | 1,75. |
Д#гидР Э+, кДж/моль. | — 500. | — 390. | — 305. | — 280. | — 246. | ; |
Потенциал ионизации, В Э°->Э+ | 5,39. | 5,14. | 4,34. | 4,18. | 3,89. | 3,98. |
Относительная электроотрицательность. | 0,98. | 0,93. | 0,82. | 0,82. | 0,79. | —. |
Плотность, г/см3 | 0,534. | 0,968. | 0,862. | 1,520. | 1,870. | 2,100. |
Температура плавления,°С. | 179,0. | 97,8. | 63,6. | 39,0. | 28,0. | 23,0. |
Температура кипения,°С. | 882,9. | |||||
Наличие в земной коре, % (мае.). | 0,0065. | 2,4. | 2,60. | 0,031. | 0,0007. | —. |
Распространение в природе и получение. Литий достаточно широко распространен в земной коре (0,0065%). Наибольшую ценность имеют минералы сподумен LiAl (Si03)2, амблигопит LiAl (P04)F и лепидолит Li2Al2(Si03)3(F, ОН)2.
Получают литий вакуум-термическим восстановлением сподумена или оксида лития, используя в качестве восстановителя кремний или алюминий, а также электролизом расплава эвтектической смеси LiCl — КС1. Особо чистый литий получают электролизом расплава эвтектической смеси хлорида и бромида лития. Его хранят под слоем вазелина или парафина в запаянных сосудах.
Натрий — один из наиболее распространенных элементов на Земле (2,4%). Он обнаружен в атмосфере Солнца и в межзвездном пространстве. Огромное количество солей натрия находится в гидросфере. Важнейшие минералы натрия: NaCl (каменная соль, галит), Na2SO410FI2O (.мирабилит, глауберова соль), (кри
олит), Na2B4O710H2O (бура) и др. В сочетании с другими элементами он входит в состав многих природных силикатов и алюмосиликатов. Соединения натрия содержатся в растительных и животных организмах.
Получают натрий электролизом расплавов NaCl или NaOH. Натрий хранят под керосином или в запаянных сосудах.
Калий, как и натрий, относится к довольно распространенным элементам (2,6%). Наиболее важными минералами являются: сильвин КС1, сильвинит NaCl-KCl, карналлит KCl-MgCl2-6II20, каинит KClMgS04-3H20.
Рубидий и цезий содержатся в минералах калия.
В технике калий получают натрий-термическим методом из расплавленного гидроксида или хлорида, рубидий и цезий — методами металлотермии и термическим разложением соединений. Калий и его аналоги хранят в запаянных сосудах. Калий, кроме того, можно хранить в керосине.
Франций радиоактивен, стабильных изотопов не имеет. Содержание его в продуктах радиоактивного распада урана ничтожно мало (4 • 10 28 г на 1 г природного урана). Его получают искусственно. Наиболее долгоживущий изотоп 212Fr (Г½ = 20 мин) образуется при облучении урана протонами. Свойства его изучены недостаточно.
Физические и химические свойства. В виде простых веществ металлы IA-подгруппы — блестящие серебристо-белые (за исключением золотисто-желтого цезия) вещества. Основные физические свойства этих металлов приведены в табл. 1.1. Как видно из приведенных данных, это довольно легкие металлы (Li, Na и К легче воды), температуры плавления и кипения невысокие. Эти металлы очень мягкие и легко режутся ножом. Характерно, что от лития к натрию и далее к калию значения большинства констант меняются довольно резко.
Взаимодействие с простыми веществами представлено на схеме:

Щелочные металлы обладают высокой химической активностью, которая возрастает от лития к цезию. На воздухе окисляются: литий образует оксид Li20 (темно-серый налет) натрий пероксид Na202, а калий, рубидий и цезий — надпероксиды Ме02 и озониды Ме03 (рыхлые продукты взаимодействия).
Восстановительная способность этих металлов настолько велика, что они восстанавливают даже атомы водорода до Н :
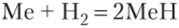
В атмосфере галогенов (фтора и хлора, а также в парах брома и иода) они самовоспламеняются при обычных условиях, цезий и франций — со взрывом. При нагревании непосредственно соединяются с серой, углеродом, водородом и другими неметаллами, образуя бинарные соединения: сульфиды Me2S, нитриды Me3N, карбиды (ацетилениды) Мс2С2 и гидриды МеН. При сплавлении натрия с серой образуются персульфиды типа Na2S2, Na2S3, Na2S4 и Na2S5. Сульфид, селенид, теллурид натрия образуются при непосредственном взаимодействии компонентов в вакууме.
С большинством металлов образуют интерметаллические соединения, с магнием, алюминием, цинком и с некоторыми другими — ограниченные твердые растворы, а с щелочными металлами — эвтектические смеси. Эвтектический сплав 24% Na и 76% К в обычных условиях представляет собой жидкость (?пл = -12,6°С).
Литий при температуре выше 200 °C загорается.
По химической активности литий уступает некоторым металлам, хотя значение его стандартного электродного потенциала наиболее отрицательное (?°298 = -3,05 В). Это обусловлено большой энтальпией гидратации иона Li+.
Отношение к воде и кислотам. Взаимодействие с водой и кислотами представлено на схеме:

Все щелочные металлы энергично разлагают воду, выделяя из нее водород:
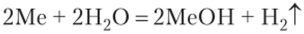
Взаимодействие калия с водой сопровождается самовоспламенением выделяющегося водорода, а взаимодействие Rb и Cs — даже взрывом.
Еще легче они взаимодействует с кислотами, вытесняя водород из разбавленных кислот (кроме азотной). Концентрированную серную и разбавленную азотную кислоты они восстанавливают до H2S и NII3 (NH4N03) соответственно.
Свойства соединений металлов подгруппы IA. Соединения с кислородом. Пероксиды. В ряду Li —> Na —> К —> Rb —" Cs возрастает тенденция к образованию иероксидных соединений (см. выше).
Для лития известен пероксид Li202, а для натрия — озонид, но устойчивость их существенно ниже, чем для К, Rb и Cs. Все пероксидные соединения легко разлагаются водой и являются очень сильными окислителями:
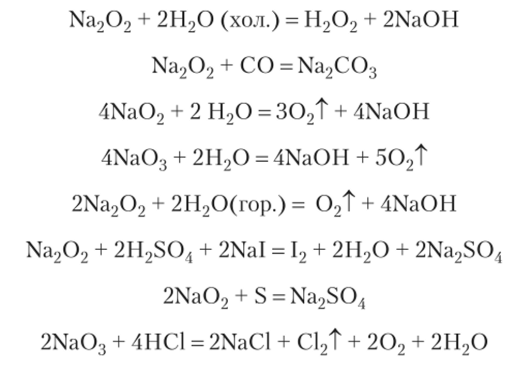
Оксиды Э20. Оксид лития Li20 и натрия Na20 — белые твердые вещества. Li20 получается взаимодействием простых веществ. Оксиды Na20 и К20, желтый Rb20 и оранжевый Cs20 получают косвенным путем — восстанавливая пероксиды металлами:

В ряду Li20 -> Na20 -> К20 -> Rb20 -> Cs20 активность возрастает. Это типичные основные оксиды. С кислотами, кислотными и амфотерными оксидами образуют соли:

Взаимодействуют с водой, образуя гидроксиды:

Гидроксиды МеОН — бесцветные гигроскопические вещества, хорошо растворимые в воде с выделением большого количества тепла. В водных растворах МеОН являются самыми сильными основаниями — щелочами (NaOH, КОН, RbOH, CsOH). Из них наибольшее значение в технике имеют гидроксиды натрия (едкий натр или каустическая сода) NaOIi и калия (едкое кали) КОП. Их получают электролизом водных растворов NaCl и КС1.
LiOH по растворимости и силе уступает остальным гидроксидам. При накаливании, в отличие от гидроксидов других щелочных металлов, LiOH разлагается:

Гидроксиды щелочных металлов, как и оксиды, энергично растворяются в кислотах, образуя соответствующие соли:

Растворы щелочей разъедают стекло, образуя силикаты Me2Si03, а также поверхность алюминия с образованием алюминатов Ме[Л1(ОН)4] и водорода Н2:
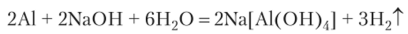
Гидроксид натрия NaOH — белые кристаллы, легко поглощают влагу и углекислый газ из воздуха (образуется гидрокарбонат NaHCQ3):

Большинство солей лития и щелочных металлов хорошо растворимы в воде. Трудно растворимыми являются LiF, Li3P04, и гидрокарбонат NaHC03, перхлораты КСЮ4, RbCl04, CsCl04, а также некоторые комплексные соли: гексанитритокобальтат (Ш) натрия Na-)fCo (NO >),-l и гексахлороплатинаты (У1) калия и рубидия K2[PtCl6], Rb2[PtCl6],.
Соединения с неметаллами представляют собою бинарные соединения — бесцветные кристаллические вещества. Они являются солями или соленодобными соединениями. Соли слабых кислот в водных растворах гидролизуются:
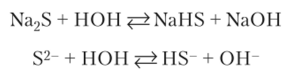
Солеподобные соединения (нитриды, карбиды, гидриды и др.) разлагаются водой: 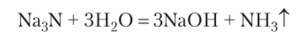
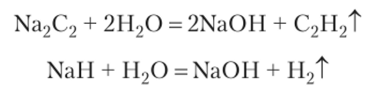
Применение. Важнейшей областью применения лития является атомная энергетика. Его используют как источник получения трития, а также в качестве теплоносителя в атомных реакторах:

Литий придает сплавам ряд ценных физико-химических свойств. Например, у сплавов алюминия с содержанием до 1% Li повышаются механическая прочность и коррозионная стойкость, введение 2% Li в техническую медь значительно увеличивает ее электрическую проводимость и т. д. Гидроксид лития LiOH применяется в качестве электролита в аккумуляторах. Минералы и искусственные соединения лития (алюминат, гитанат, карбонат, силикат, молибдат и др.) применяются при производстве эмалей, специальных стекол, пропускающих ультрафиолетовые лучи, и др.
Металлоргаиические соединения лития широко применяются в органическом синтезе.
Натрий используется в качестве теплоносителя в ядерных энергетических установках, в металлотермии, а также в клапанах авиационных двигателей, в химических производствах, где требуется равномерный обогрев в пределах 450—650°С. Металлический натрий и его жидкий сплав с калием используются в органическом синтезе. Амальгама натрия часто применяется как восстановитель. Гидроксид натрия используется при производстве мыла, красок, целлюлозы и др., входит в состав растворителей неактивных металлов, а также элементарных и сложных полупроводниковых материалов.
Хлорид натрия является основой для целого ряда важнейших производств, таких как производство натрия, едкого натра, соды, хлора и др.
Карбонаты натрия применяются во многих отраслях промышленности: химической, мыловаренной, бумажной, текстильной, пищевой и др.
Около 90% добываемых солей калия (в виде KN03, КС1, K2S04 и др.) используются в качестве удобрений, при производстве стекол, мыла и др. Соединения калия, рубидия, цезия и франция используются в медицине.
Токсичность элементов. Практически опасность представляют лишь щелочные металлы и их гидроксиды, вызывая ожоги кожи. Особенно опасно попадание даже самых малых количеств щелочей в глаза.