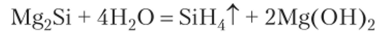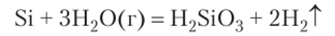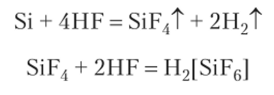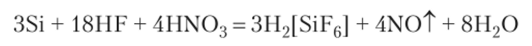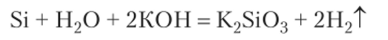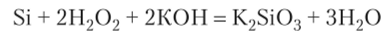В соответствии с характерным типом гибридизации валентных орбиталей (sp3) у кремния наиболее устойчива алмазоподобная (кубическая) модификация (рис. 4.3).
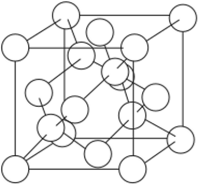
Рис. 4.3. Атомная решетка алмаза.
Как и алмаз, он тугоплавок (?пл = 1412°С) и отличается высокой твердостью, но имеет темно-серый цвет и металлический вид, обладает полупроводниковыми свойствами (ДЕ =1,12 эВ).
Кристаллический кремний довольно инертен, более активен аморфный кремний. Он обладает окислительно-восстановительной двойственностью с преобладанием восстановительных свойств.
Взаимодействие с простьши веществами. С металлами (Mg, Са, Си, Fe, Pt, Bi) кремний взаимодействует при нагревании, образуя силициды. При этом он проявляет окислительные свойства:
С Al, Zn, Sn, Pb, Au, Ag кремний силицидов не образует.
Фтором он окисляется при нормальных условиях с образованием фторида, остальными неметаллами — лишь при нагревании. Так, с хлором он взаимодействует при 400 °C, с кислородом и серой — при 600 °C, с азотом лишь при 1300 °C, а с углеродом и бором — при 2000 °C, образуя соответственно хлорид, оксид, сульфид, нитрид Si3N4, карбид SiC и смесь боридов SiB3 и SiB6:
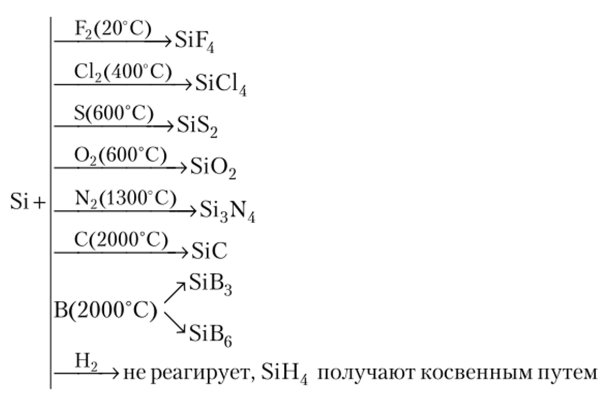
С водородом кремний непосредственно не реагирует. Силан SiH4 получают из силицидов, действуя на них водой или соляной кислотой:
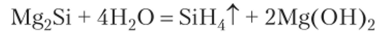
Отношение к воде, кислотам и щелочам. С водой в обычных условиях кремний не реагирует, но при высоких температурах (выше 800°С) окисляется:
По отношению к кислотам кремний довольно инертен. Концентрированными кислотами H2S04 и HN ()3 он пассивируется вследствие образования защитной пленки Si02, не растворяющейся в воде и кислотах. Кремний растворяется только в большом избытке плавиковой кислоты HF (реакция протекает в две стадии):
и в смеси плавиковой и азотной кислот с образованием комплексной кислоты:
В щелочах кремний растворяется с выделением водорода: 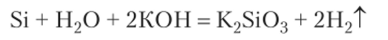
Добавление окислителей (в частности, Н202) и нагревание ускоряют процесс растворения: