Реакции термического разложения

В последние годы множатся сведения о термическом разложении комплексных соединений второго типа с достаточно «рыхлой» структурой. К сожалению, их кинетической интерпретации либо не проводится, либо делаются умозрительные заключения, как о механизмах термолиза, так и о соответствующих переходных состояниях. Типичным здесь является обзор Ю. Н. Шевченко (1990), в котором обсуждается связь между… Читать ещё >
Реакции термического разложения (реферат, курсовая, диплом, контрольная)
Наибольшее число кинетических данных известно для твердофазных реакций (эти реакции подробно описаны в пособии Ю. Д. Третьякова[1][2][3] и здесь не рассматриваются) либо для реакций термического разложения. При этом с точки зрения механизмов термическое разложение относительно изучено для веществ, в особенности достаточно легко образующих крупные кристаллы.
Одним из них является КМп04, относящийся к ионным кристаллам.
Как показали еще Праут и Томпкинс (1944), разложение КМп04 начинается на дефектах кристаллов, типа краевых дислокаций, где энергия активации разложения аниона относительно низка. Образовавшийся на поверхности продукт вызывает микронапряжения, способствующие растрескиванию кристаллов исходного реагента (можно рассматривать как твердотельный аналог «ветвления цепей»), причем самодиспергирование заканчивается при степени превращения, а ~ 0,3. Известны эффекты старения и предварительной обработки кристаллов, проявляющиеся в изменении формальных констант скорости, энергий активации, а также в изменении законов разложения: они описываются разными уравнениями:

В КМп04 происходит перенос электрона по анионной подрешетке, а ионы Мп04" объединяются в димеры и более крупные ассоциаты. Это сказывается на скорости разложения, которое протекает по суммарной схеме.
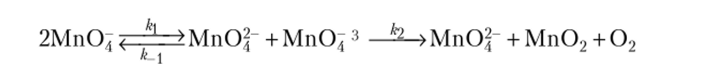
Кинетическое уравнение (по Болдыреву) имеет вид.
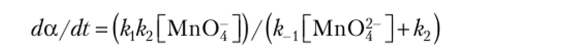
причем концентрацию иона Мп04 относят к единице площади РГРФ, а концентрацию иона Мп04~ — к числу электронов проводимости. Структурные дефекты могут обусловливать и тот известный факт, что уже при получении кристаллов КМп04 в них существует ощутимое (по крайней мере, методом ЭПР) количество кластеров, содержащих ионы Мп04~ Катализируют разложение разнообразные добавки. Кристаллы чувствительны к облучению УФ, рентгеновским и у-излучением, что понятно, так как они могут генерировать ионы МпО? пусть даже и в небольших количествах.
В последние годы множатся сведения о термическом разложении комплексных соединений второго типа с достаточно «рыхлой» структурой. К сожалению, их кинетической интерпретации либо не проводится, либо делаются умозрительные заключения, как о механизмах термолиза, так и о соответствующих переходных состояниях. Типичным здесь является обзор Ю. Н. Шевченко (1990), в котором обсуждается связь между строением и свойствами кристаллических комплексных солей и стехиометрией твердофазных реакций замещения лигандов, а также механизм термической цис-транс-изомеризации тетрааминных комплексов хрома (III) и кобальта (III)[4][5] по данным термоаналитических экспериментов (это преимущественно результаты неизотермических опытов). Механизмы термического разложения указанных комплексов трактуются с точки зрения энергетики (для комплексных соединений это типичный подход) с опорой на расчеты по циклу Борна — Габера. В этой работе также обсуждаются результаты определения массового баланса реакций термолиза солей типа [М (Аш)4Х2]Х, где М = Cr3+, Со3+; Am = NH2CH3, 'Леп, И>pn, V4tn, линейных тетрааминов 2,3,2-tet и др.; Х=С1″, Br", C2B9Hf[ и др., наличие или отсутствие изомеризации, а также образование изомеров.
Работы Шевченко интересны другим. В них сделана попытка выяснения роли кристаллической решетки в реакциях замещения лигандов на примере аминных комплексов хрома (III). Автором синтезированы твердые пористые вещества, представляющие собой аморфные органосилоксановые матрицы, внутри которых располагаются комплексы хрома. Были выделены и идентифицированы: 1) [СгО, 3(en)2(Oi 5SiCH3)r], гдех= 117 11]; 2) [Cr01,5(NH2CH2CH3)3(Ol,5SiCH3)J", гдех = 72 [И)] и 96 [III]. В этих соединениях комплексы располагаются в полостях, образуемых органосилоксаном (рис. 14.3). В таких матрицах кристаллическая решетка отсутствует, а комплексы включения рассредоточены по объему, располагаясь в полостях, образуемых тетраэдрами RSi015, где R=CH3, С2Н5 или другой органический радикал. От кристаллов эти соединения отличаются переменным составом, а от растворов — низкой подвижностью встроенных групп.


лграис-[Сг (сп)2(Ом)2]+ ^wr-[Cr (cn)(0,M)2]+ rapa?2Et)3(0M)3|.
Рис. 14.3. Схема расположения комплексов внутри кремнийорганической матрицы На основании опытов по изотермическому разложению установлено, что в интервале 200—500°С, например, соединение I диссоциирует в две стадии, последовательно отщепляя на каждой стадии молекулу этилендиамина. Превращения характеризуются следующими уравнениями массового баланса:
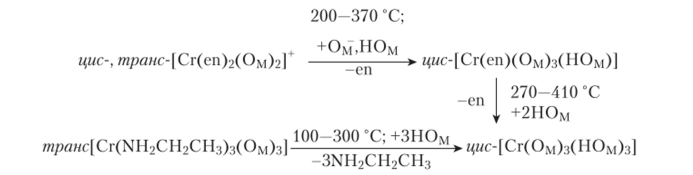
где Ом — донорный атом кислорода матрицы, несущий отрицательный заряд; НОм — гидроксильная группа матрицы.
Для процессов в матрице из-за отсутствия межфазных границ замещение лигандов в соединениях I, II, III протекает, но механизму случайного образования зародышей и описывается уравнением /(а) = (1 — а)[ — ln (1 — а)]¾ (уравнение Аврами). Реакция распространяется в трех направлениях (0,06 < а < 0,50; изотермические эксперименты, кинетические характеристики рассчитаны из кривых газовыделения). Напротив, кристаллические хлоропентакис (этиламин) хром (III) хлорид и трис-(этилендиамин) хром.
(III) бромид разлагаются по закону /(а) = (1 — а)2/3, соответствующему диффузионно-контролируемой реакции в модели сжимающейся сферы (0,06 < а < 0,50).
Отмеченные различия, безусловно, связаны с наличием определенной степени свободы для движения комплекса металла в полости матрицы. Это радикально изменяет энергетику реакции и позволяет предполагать ассоциативный характер процесса замещения лигандов в матрице.
В целом установление детальных механизмов термического разложения координационных соединений представляет определенные затруднения, которые носят, прежде всего, идеологический характер. Еще большие трудности возникают при исследовании реакций твердых тел других типов. Следствием этого часто является феноменологический характер наблюдаемых зависимостей количества прореагировавшего вещества от времени. Расчетные скорости превращений обычно трудно сравнивать непосредственно, особенно если процессы изучались в различных условиях эксперимента и в аппаратуре с различной геометрией реакционного пространства. Поэтому на первом этапе помимо стехиометрии изучаемого процесса при конкретных и воспроизводимых условиях эксперимента, включающих и размерные параметры аппаратуры, желательно выявлять наиболее значимые факторы, замедляющие или ускоряющие процесс, а также приемы, позволяющие минимизировать их влияние. Особенно это важно в том случае, когда возникают проблемы, связанные с материалами реакторов в связи с высокой химической активностью реагентов. Последнее характерно для реакций окислительного фторирования, обзор которых был составлен в 1997 г., но не потерял актуальности до сих пор.
- [1] Третьяков Ю. Д. Твердофазные реакции. М.: Химия, 1978.
- [2] Здесь п = р + X, где Р — число стадий зародышеобразования, X — числонаправлений эффективного роста зародышей.
- [3] Существование этого соединения невозможно, хотя В. В. Болдырев егои постулирует. По-видимому, здесь следует рассматривать в качестве интермедиатаописанное в литературе двойное соединение, содержащее одновременно ионыМпО^ и MnOf.
- [4] Аналогичные кластеры известны и для других объектов. Недавно, например, они были обнаружены в твердых вольфраматах щелочных металлов, образующихся при взаимодействии М'02 с W03 при нагревании до умеренных температур (см. Koksharov Yu. A., Avdey А. V., Dolgenko V. D., Kiselev Yu. M. // Mendeleev Comm.2005. V. 15. № 2. P. 77).
- [5] Шевченко 10. / в сб. Термический анализ неорганических и органическихматериалов. Кишинев: Штиинца, 1990. С. 110.