Бор.
Неорганическая химия

Бор в сельском хозяйстве. Среднее содержание бора в почвах (1 • 10 3%) и в растениях (1 • 10 4%) невелико, но достаточно, чтобы бор оказывал большое влияние на развитие растений. Поэтому бор относится к числу жизненно важных микроэлементов. Хотя формы биосоединений и механизм биологической активности бора не установлены, показано, что в растительных клетках большая часть бора сосредоточена… Читать ещё >
Бор. Неорганическая химия (реферат, курсовая, диплом, контрольная)
Элементное состояние. Известно более 10 аллотропных модификаций бора, в том числе и аморфная форма. Наиболее устойчива кристаллическая p-ромбоэдрическая модификация, свойства которой приведены в табл. 17.2. Все другие модификации бора термодинамически менее устойчивы и переходят в р-ромбоэдрическую при температурах выше 1500 °C. Кристаллические решетки всех модификаций бора состоят из структурных единиц, имеющих форму правильного двадцатигранника (икосаэдра), образованного из 12 атомов бора (рис. 17.1). Атомы бора внутри одного икосаэдра и икосаэдры меж.
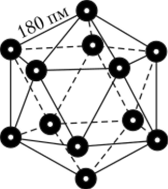
Рис. 17.1. Элементарная ячейка структуры бора — икосаэдр.
ду сооои связаны очень прочно, поэтому кристаллический бор имеет высокие температуры плавления и кипения, а также большую твердость. Тверже него из простых веществ только алмаз. Бор — полупроводник.
Получение. Бор можно получить в аморфной форме или в одной из кристаллических модификаций в зависимости от температуры, при которой происходит реакция. При самой низкой температуре (600—800°С) образуется аморфная фор ма путем восстановления оксида бора сильными восстановителям и — м ста л лам и:
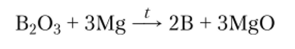
Кристаллический бор получают восстановлением хлорида или фторида бора водородом:
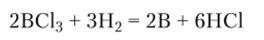
или разложением галогенидов бора или В2Нб при температурах от 1000 до 1500 °C Химические свойства. При обычных условиях элементный бор (в особенности кристаллический) химически инертен и взаимодействует только с фтором. При высоких температурах (400—700°С) он реагирует с другими галогенами с образованием галогенидов бора:
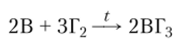
где Г = F, Br, Cl, I.
При высоких температурах бор окисляется также кислородом, серой, азотом и фосфором с образованием бинарных соединений, в которых он, как и в галогенидах, проявляет степень окисления +3.
При температурах выше 1000 °C бор взаимодействует с кремнием с образованием боридов кремния, а при температурах выше 2000 °C он реагирует с углеродом с образованием карбидов бора. С водородом бор не взаимодействует, поэтому получение гидридов бора прямым синтезом из элементов невозможно. При высоких температурах бор реагирует с большинством металлов и образует бориды. В табл. 17.3 приведены формулы боридов бериллия, магния и алюминия.
Таблица 173
Бинарные соединения бора и их значения ДG°f 29S (кДж /моль).
B2H6®. 89,6. | |||||
ВсВ9(к). — 65. | B4C (k). — 38,3. | BN (k). — 228. | В203(к). — 1193. | BF3®. — 1120. | |
MgB2(x). — 100,3. | A1B12(k). — 236,3. | B4Si (K). >0. | BP (k). — 94,8. | B2S;)(k). — 238. | BCl3®. — 389. |
На чистый элементный бор не действуют кипящие хлороводородная и фтороводородная кислоты, однако он окисляется газообразными HF и НС1 при температурах выше 500 °C с выделением водорода. Горячие кислоты-окислители — концентрированная азотная и хромовая кислоты, а также «царская водка» медленно окисляют бор до борной кислоты. При сплавлении бора с щелочами в присутствии кислорода образуются бораты.
Бинарные соединения. С подавляющим большинством элементов бор образует термодинамически устойчивые соединения (см. табл. 17.3). Исключение составляют многочисленные и разнообразные по строению молекул гидриды этого элемента.
Гидриды. Соединения бора с водородом называют также боранами или бороводородами. Все они термодинамически неустойчивы, имеют очень большие энтальпии сгорания и чрезвычайно токсичны.
Гидрид бора, отвечающий простейшей формуле В113, в обычных условиях не существует. Однако известно несколько десятков соединений бора с водородом более сложного состава, самое простое из которых диборан отвечает формуле В2Не. Для молекул гидридов бора, в том числе и для молекулы диборана, характерен дефицит электронов (см. с. 191).
При нагревании без доступа воздуха бораны разлагаются на бор и водород, что используется для получения чистого элементного бора. На воздухе они воспламеняются и сгорают с выделением большого количества теплоты:
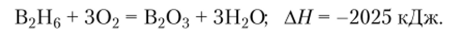
При взаимодействии боранов с водой образуется борная кислота и выделяется водород:
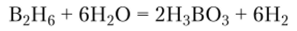
Галогениды. При обычных условиях галогениды бора находятся в разных агрегатных состояниях: фторид бора BF3 и хлорид бора ВС13 — газы, бромид бора ВВг3 — жидкость, иодид бора В13 — твердое вещество. Все галогениды бора гидролизуются:
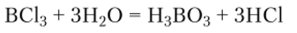
Молекулы галогенидов бора имеют форму плоского треугольника с углом ГВГ (где Г — галоген) 120° (рис. 17.2), что объясняется переходом одного из электронов с 2л-подуровня на подуровень 2р
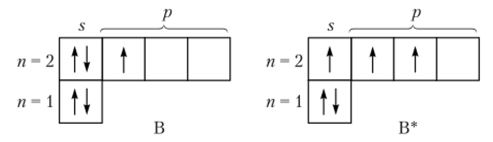
и 5/?2-гибридизацией орбиталей атома бора. Наличие свободной орбитали придает галогенидам бора акцепторные свойства. При взаимодействии с электроно-донорными частицами галогениды бора образуют комплексные соединения:
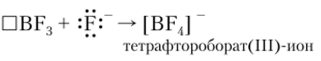
При заполнении электронами всех четырех орбиталей атома бора происходит $р3-гибридизация, поэтому комплексные соединения имеют тетраэдрическое строение. Этот тип гибридизации характерен для всех комплексных соединений, в которых бор играет роль комплексообразователя.
Кроме тригалогепидов, известны галогениды, состав которых описывается формулами В2Г4, В4Г4 и В3Г3. В молекулах этих галогенидов имеются связи В—В.
Оксид. Обычно оксид бора В203 находится в стеклообразном состоянии. Это бесцветное хрупкое вещество. Стеклообразный В03 имеет слоистую структуру. Слои состоят из.
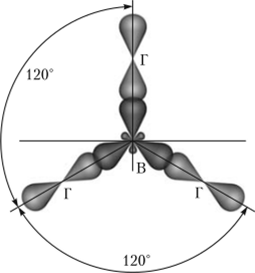
Рис. 17.2. Схема перекрывания $р2-гибридных орбиталей атома бора и негибридизованных р-орбиталей трех атомов галогенов правильных треугольников В03 с атомом бора в центре, связанных между собой общими атомами кислорода.
Оксид бора — кислотный оксид. При взаимодействии с водой он образует ортоборную кислоту:
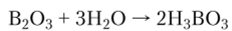
Сульфид. Как и оксид, сульфид бора B2S3 обычно существует в стеклообразном состоянии. Кристаллический сульфид бора имеет слоистую структуру. Слои образованы циклами, состоящими из четырех (B2S2) или шести (B3S3) атомов. Циклы связаны друг с другом общими атомами серы.
Нитрид. Известны три кристаллические модификации нитрида бора BN. Все они химически инертны. При обычных условиях устойчива сходная по структуре с графитом слоистая модификация. Слои состоят из связанных между собой шестичленных циклов B3N3. Эту модификацию нитрида бора используют для изготовления огнеупорных материалов и как сухую смазку в подшипниках. Две другие кристаллические модификации получаются из графитоподобной при высоких давлениях. По твердости они близки к алмазу (одна из них имеет алмазоподобную структуру) и применяются как сверхтвердые абразивные материалы.
Фосфид и арсенид. Фосфид бора ВР и арсенид бора BAs имеют алмазоподобную структуру и высокую химическую стойкость. Оба вещества — высокотемпературные полупроводники.
Карбиды. Это кристаллические вещества, имеющие сложную структуру и отличающиеся высокой химической устойчивостью. Они не взаимодействуют с водой и с растворами кислот и щелочей. Их используют для изготовления жаропрочной керамики и в ядерной энергетике.
Бориды. Соединения бора с более электроотрицательными, чем бор, элементами называют боридами. Бор может образовывать с одним и тем же элементом несколько боридов разного состава. Некоторые бориды применяют как жаропрочные, износостойкие или нейтрононоглощающие материалы.
Борные кислоты, бораты. Важнейшие из кислот бора — ортоборная и метаборная — представляют собой бесцветные кристаллические вещества. В водных растворах устойчива только ортоборная кислота: все другие борные кислоты, присоединяя воду, превращаются в нее.
Ортоборная кислота. Часто ортоборную кислоту Н3В03 называют просто борной кислотой. Это бесцветное кристаллическое вещество. Слоистая структура кристаллов обусловлена образованием водородных связей между молекулами Н3В03 с 5р2-гибидизацией электронных орбиталей атома бора (рис. 17.3). Слои соединены между собой слабыми силами Вандер-Ваальса. Расстояние между слоями очень велико: 318 пм.
Ортоборная кислота — слабая кислота (К = 5,8 • 10 10). В отличие от обычных кислот она не отщепляет катион Н+, а вызывает смещение равновесия диссоциации молекул воды, присоединяя за счет донорно-акцепторного взаимодействия гидроксид-ионы ОН-: 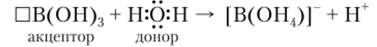
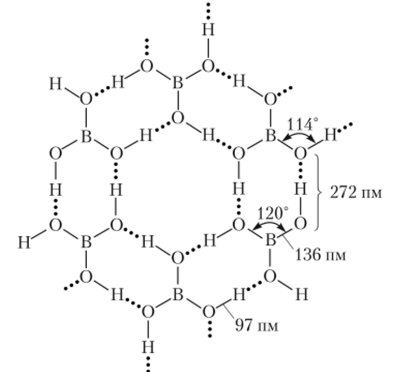
Рис. 173. Часть слоя в структуре ортоборной кислоты.
Образующийся при этом тетрагидроксоборат (Ш)-ион имеет форму тетраэдра с 5р3-гибридизацией электронных орбиталей атома бора.
При нейтрализации ортоборной кислоты не образуются ортобораты, содержащие ион ВО|_, а получаются метабораты, например метаборат натрия:
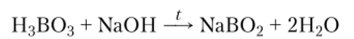
или соли полиборных кислот, например тетраборат натрия:
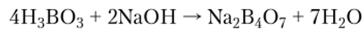
Со спиртами в присутствии серной кислоты Н3В03 образует летучие эфиры, при горении которых пламя окрашивается в зеленый цвет:
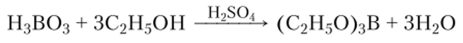
Эту реакцию используют в аналитической химии для обнаружения борной кислоты и боратов.
Ортоборная кислота слабо токсична для теплокровных животных и человека. Она не имеет противоядий и медленно выводится из организма. Ее использование в качестве антисептического средства для детей и кормящих матерей запрещено в нашей стране с 1987 г.
В природе ортоборная кислота встречается в виде минерала сассолина.
Метаборпая кислота. Бесцветная кристаллическая метаборная кислота ПВ02 образуется при частичном обезвоживании ортоборной кислоты.
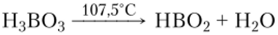
НВ02 — простейшая формула, общая для трех различных кристаллических модификаций метаборной кислоты. Одна из этих кристаллических модификаций имеет слоистую структуру, состоящую из молекул (НВ02)3, объединенных водородными связями:
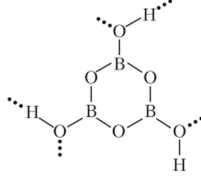
Другие кристаллические модификации имеют более сложное строение.
При взаимодействии с водой метаборная кислота легко превращается в ортоборную:
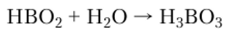
При полном обезвоживании метаборной кислоты получается оксид бора:
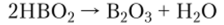
Полиборные кислоты. В водных растворах, по-видимому, существуют полиборные кислоты, например тетраборная кислота Н2В407, которые не могут быть выделены в свободном состоянии.
Бораты. Соли борных кислот объединяют под общим названием бораты. Наибольшее применение находит декагидрат тетрабората натрия (бура) Na2B407 * 10Н2О — бесцветное кристаллическое вещество, в структуре которого присутствует циклический анион:
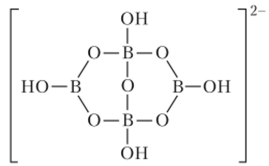
Поэтому формулу этой соли правильнее записывать так: Na^B/jC^OH)^ -8Н20. С помощью водородных связей такие циклические анионы объединяются в цепи. Гидратированные катионы натрия также образуют цени из октаэдров [Na (H20)6], имеющих общие ребра, поэтому в буре на один катион натрия приходится четыре молекулы воды. Водные растворы тетрабората натрия имеют щелочную реакцию и проявляют буферные свойства. Тетраборат натрия используют в производстве боросиликатных стекол, глазурей, эмалей и моющих средств, в качестве антисептического средства, как консервант при обработке кож.
Бор в сельском хозяйстве. Среднее содержание бора в почвах (1 • 10 3%) и в растениях (1 • 10 4%) невелико, но достаточно, чтобы бор оказывал большое влияние на развитие растений. Поэтому бор относится к числу жизненно важных микроэлементов. Хотя формы биосоединений и механизм биологической активности бора не установлены, показано, что в растительных клетках большая часть бора сосредоточена в клеточных стенках. Бораты ингибируют некоторые ферментативные реакции, при недостатке бора происходит разрушение мембран, бор оказывает большое влияние на метаболизм и транспорт углеводов. При недостатке бора у растений отмирают точки роста, проявляется некроз тканей, при отсутствии бора в почве растения не дают семян.
Для устранения дефицита бора используют борные удобрения, в качестве которых выступают ортоборная кислота, бура и бормагниевые удобрения. Последние являются отходами в производстве Н3В03. Путем введения добавок ортоборной кислоты, буры, метабората кальция Са (В02)2-2Н20 или концентратов борсодержащих руд к минеральным удобрениям в процессе их производства получают борные суперфосфаты, борнитроаммофоску и бораммофос.
Избыточное содержание бора в почвах так же нежелательно, как и недостаток, потому что оно вызывает заболевания растений. При высоких концентрациях бора в кормах наблюдаются энтериты животных.