Кремний.
Неорганическая химия

Кристаллические силикаты и алюмосиликаты. Природные и синтетические кристаллические силикаты, как и поликремниевые кислоты и кварц, имеют в качестве структурной единицы кремнекислородный тетраэдр Si04 (см. рис. 18.8). Кремнекислородные тетраэдры всегда соединяются друг с другом только одной вершиной и никогда ребрами или гранями. В результате этого существует большое многообразие кристаллических… Читать ещё >
Кремний. Неорганическая химия (реферат, курсовая, диплом, контрольная)
Элементное состояние. Кристаллический кремний — вещество серого цвета с тусклым металлическим блеском. Он имеет алмазоиодобную структуру с-гибридизацией электронных орбиталей атомов Si. Кремний хрупок, имеет высокие температуры плавления и кипения, проявляет полупроводниковые свойства.
Получение. Элементный кремний получают при высоких температурах восстановлением расплавленного оксида кремния углеродом:
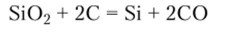
Особо чистый кремний для полупроводниковых приборов получают восстановлением очищенного от примесей тетрахлорида кремния SiC^ водородом или термическим разложением также очищенного моносилана SiH4.
Химические свойства. При обычных условиях кремний химически инертен и реагирует только с фтором с образованием тетрафторида кремния:
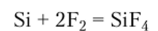
С остальными галогенами он реагирует при повышенных температурах.
От взаимодействия с кислородом даже при нагревании кремний защищает оксидная пленка. Реакция.
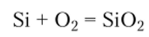
происходит только при температурах выше 4()0°С. При еще более высокой температуре кремний реагирует с парами серы, азотом, фосфором, углеродом и бором с образованием соответствующих бинарных соединений. С большинством металлов кремний образует силициды. С водородом и подавляющим большинством кислот кремний не реагирует. Он вступает в реакцию только со смесью азотной и фтороводородной кислот. Кремний растворяется в горячих растворах щелочей:
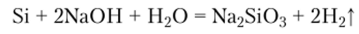
Бинарные соединения. Кремний образует прочные а-связи Si—Н, Si—С, Si—N, Si—О, Si—Е Его связи с элементами третьего периода гораздо слабее. Исключение составляет связь Si—Cl. Бинарные соединения кремния с прочными связями характеризуются большими отрицательными значениями Л Gy 298 (табл. 18.5).
Гидриды. Соединения кремния с водородом (силаны) образуют гомологический ряд с общей формулой Si/?H2w+2 по" добно предельным углеводородам, но отличаются от них меньшей прочностью цепей из-за невысокой энергии связи Si—Si (см. с. 353). Максимальное значение п в общей формуле силанов равно 8. В силанах имеет место 5р3-гибридизация электронных орбиталей атома кремния, поэтому молекулы первого члена гомологического ряда — моносилана SiH4 имеют форму тетраэдра. Температуры плавления и кипения в гомологическом ряду силанов увеличиваются быстрее, чем у углеводородов. При обычных условиях только моносилан и дисилан Si2H6 — газы. Остальные силаны — летучие жидкости. Все силаны бесцветны, ядовиты, имеют неприятный запах.
Получают силаны либо разложением силицида магния под действием хлороводородной кислоты в атмосфере водорода:
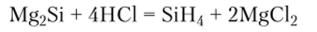
либо восстановлением галогенидов кремния водородом, гидридом лития или тетрагидридоалюминатом (И1) лития:
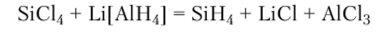
Таблица 185.
Бинарные соединения кремния и их значения AGj 298 (кДж/моль).
SiH4®. — 57,2. | ||||||
Li4Si (K). <0. | ; | B4Si (K). >0. | SiC (K). — 63,7. | Si3N4(K). — 647,7. | Si02(a). — 910,9. | SiF4®. — 1572,5. |
Na4Si (K). <0. | Mg2Si (K). — 103,6. | ; | Si (K). | SiP (K). — 71,7. | SiS9(K). — 287. | SiCl4(>K). — 617,6. |
Силициды. | Ковалентные каркасные кристаллы. | Ковалентные молекулярные соединения. | ||||
Для простоты в обоих уравнениях в качестве продукта реакции записан только моносилан, на самом деле всегда образуется смесь, состоящая из всех членов гомологического ряда силанов. Разделяя эту смесь, получают индивидуальные вещества. Количество каждого из силанов в смеси тем меньше, чем больше его молекулярная масса.
Силаны — очень реакционноспособные восстановители. Они чрезвычайно интенсивно взаимодействуют с кислородом. Моносилан реагирует с кислородом со вспышкой даже при низких температурах:
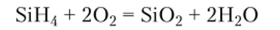
Трисилан Si3H8 и последующие члены гомологического ряда при контакте с кислородом взрываются. С галогенами силаны также реагируют со взрывом. В присутствии щелочей силаны взаимодействуют с водой:
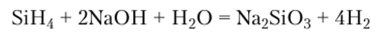
Галогениды. Существуют и термодинамически устойчивы все бинарные тетрагалогениды кремния: фторид кремния SiF4 — бесцветный газ, хлорид кремния SiCl4 и бромид кремния SiBr4 — бесцветные жидкости, иодид кремния Sil4 — бесцветное кристаллическое вещество. Электронные орбитали атомов кремния в тетраэдрических по структуре молекулах тетрагалогенидов проявляют .^-гибридизацию.
Тетрафторид кремния SiF4 подвергается гидролизу с образованием гексафторокремниевой кислоты и геля диоксида кремния:
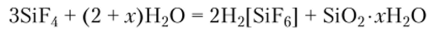
При растворении SiF4 во фтороводородной кислоте образуется неустойчивая, но диссоциирующая как сильный электролит гексафторокремниевая кислота:
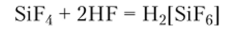
Соли этой кислоты — гексафторосиликаты, например гексафторосиликат (1У) натрия Na2[SiF6]. Эта соль находит широкое применение в разных отраслях хозяйства, в частности для фторирования воды на станциях водоочистки и как консервант древесины в строительстве.
Наряду с тетрагалогенидами известны галогениды кремния составов Siwr2" + 2″ гДе Г = F, Cl, Br, I. Их называют фтор-, хлор-, броми иодсиланами, п принимает различные значения для разных галогенов, но не больше четырех. Существуют также смешанные галогениды кремния состава SiX SiX"r4 где X — атом водорода или другого галогена.
Оксид. Диоксид кремния [оксид кремния (1У), кремнезем] Si02 — бесцветное соединение, которое может существовать в кристаллической, аморфной и стеклообразной форме. В кристаллической форме Si02 образует несколько модификаций, различающихся особенностями взаимного расположения структурных единиц — кремнекислородных тетраэдров SiO/, (рис. 18.8). Взаимные превращения кристаллических модификаций диоксида кремния сопровождаются изменениями объема и плотности. Каждому такому переходу соответствует определенная температура.
Наиболее устойчивая и поэтому самая распространенная модификация диоксида кремния — а-кварц (горный хрусталь). Это бесцветное кристаллическое вещество с сильным двойным лучепреломлением, очень твердое (уступает только топазу, корунду и алмазу) и тугоплавкое. Физические свойства кварца объясняются двумя характеристиками его алмазоподобной структуры. Как каждый атом углерода в алмазе соединен с четырьмя другими атомами связями С—С, так и каждый атом кремния кремнекислородного тетраэдра в кварце соединен с четырьмя другими кремнекислородными тетраэдрами линейными фрагментами Si—О—Si, в которых орбитали атома кислорода имеют sp-гибридизацию. Энергия каждой связи Si—О составляет 368 кДж/моль, что даже несколько больше энергии связи С—С (348 кДж/моль). Но фрагменты Si—О—Si обладают некоторой гибкостью, и поэтому кварц несколько менее тверд и менее хрупок, чем алмаз.
Расплав Si02 при быстром охлаждении образует так называемое кварцевое стекло, в котором взаимное расположение кремнекислородных тетраэдров становится неупорядоченным. Несмотря на метастабильность, кварцевое стекло способно сохранять свои ценные свойства — жаропрочность и химическую инертность — неограниченно долго. При вы;
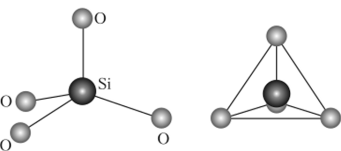
Рис. 18.8. Различные способы изображения кремнекислородного тетраэдра соких температурах кварцевое стекло пластично. Это ценное качество используют для изготовления из него разнообразных изделий: оптических волокон, химической посуды и т. п.
Кристаллический кварц химически очень инертен. При обычных температурах он взаимодействует только с газообразным F2 и с водным раствором фтороводородной (плавиковой) кислоты с образованием SiF4 и Н20.
С водой компактный кристаллический а-кварц не взаимодействует. Но аморфные формы при обычных температурах, а мелкокристаллические — при температурах выше 150 °C и высоких давлениях — очень медленно растворяются в воде с образованием ортокремниевой кислоты:
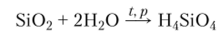
В растворах щелочей растворение Si02 происходит гораздо быстрее, чем в воде, и тем быстрее, чем выше концентрация гидроксид-иона ОП и выше температура:
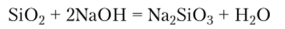
Сульфид. Бинарное соединение кремния с серой — дисульфид кремния SiS2 — бесцветное кристаллическое вещество, имеющее в качестве структурной единицы своего строения тетраэдр SiS4. Но в отличие от Si02 и силикатов, где тетраэдры Si04 соединяются лишь вершинами, т. е. единственной связью, тетраэдры SiS4 образуют цепи, в которых они связаны двумя вершинами. Поэтому SiS2 не образует класс соединений, подобных силикатам. SiS2 легко гидролизуется:
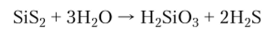
Нитрид. Термостойкий, химически инертный, кристаллический нитрид кремния Si3N4 очень медленно гидролизуется. Его применяют как компонент керамических составов.
Фосфиды. При взаимодействии паров фосфора с кремнием при высокой температуре образуется желто-коричневый SiP, а при взаимодействии фосфина РН3 и силана SiH4 получается голубовато-черный Si2P. Фосфиды кремния устойчивы на воздухе, разлагаются горячей водой, растворами щелочей и горячими растворами неорганических кислот.
Карбид. Еще более термостоек и химически инертен, чем Si3N4, карбид кремния (карборунд) SiC. Структура его кристаллов алмазоподобна, орбитали чередующихся атомов углерода и кремния проявляют в ней хр3-гибридизацию. Так как энергия связи Si—С (290 кДж/моль) ниже энергии связи С—С (348 кДж/моль), карборунд уступает по твердости алмазу, но немного. Его широко применяют как абразивный материал для изготовления шлифовальных дисков и как огнеупор в металлургии.
Получение карборунда осуществляют сплавлением Si02 с коксом:
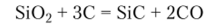
При высоких температурах SiC взаимодействует с парами воды:
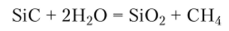
Бориды. Химически очень инертны бориды кремния B3Si, B4Si, B6Si и B!2Si, которые применяют в качестве термостойких и огнеупорных материалов.
Силициды. Разнообразны и часто имеют сложные кристаллические структуры силициды щелочноземельных и щелочных металлов.
Кремниевые кислоты, силикаты. Кислородсодержащие кислоты кремния и особенно их соли очень многочисленны и разнообразны по структуре. Силикаты и кремнезем составляют основу подавляющего большинства горных пород и продуктов их выветривания. Они же являются важнейшими компонентами минеральной части почвы. Большинство неорганических строительных материалов, как природных (гранит), так и производимых промышленностью (кирпич, цемент, бетон, стекло), представляют собой силикаты.
Ортокремниевая кислота. Простейшая из кремниевых кислот — ортокремниевая кислота имеет формулу H4Si04. Как и в кварце, орбитали атома кремния в ней проявляют 5р3-гибридизацию, образуя четыре прочные связи Si—О:
При получении II4Si04 растворением аморфного Si02, например обезвоженного при высоких температурах геля поликремниевых кислот, достигается концентрация насыщения водного раствора H4Si04. Ее растворимость в воде невелика и составляет -125 мг/л (0,0013 моль/л). H4Si04 существует только в водных растворах и является очень слабой кислотой № = Ю).
Поликремниевые кислоты. В водных растворах легко идет конденсация ортокремниевой кислоты, в результате которой образуются поликремниевые кислоты:
Итоговую реакцию растворения аморфных форм диоксида кремния можно записать так:
С повышением концентрации H4Si04 при медленном упаривании сначала образуются мутные коллоидные растворы ноликремниевых кислот — золи, а затем студенистые осадки — гели. Высушиванием и прокаливанием концентрированных гелей кремниевых поликислот получают твердые силикагели — прозрачные зернистые микропористые вещества. Силикагели обладают сильной адсорбирующей способностью, их широко применяют для извлечения разнообразных молекулярных соединений из растворов или из газовой фазы.
Силикаты. Соли кремниевых кислот объединяют под названием силикаты. Силикаты щелочных металлов растворимы гораздо лучше, чем поликремниевые кислоты. Желеобразные растворы натриевых солей поликремниевых кислот, известные иод названием жидкое стекло, широко применяют как силикатный клей и в качестве консерванта древесины. При контакте с воздухом растворы жидкого стекла поглощают С02. Так как Н2С03 гораздо более сильная кислота, чем кремниевые кислоты, они при этом выпадают в осадок и образуют склеивающую или изолирующую пленку.
Сплавлением карбоната натрия, карбоната кальция и Si02 получают стекло, которое является переохлажденным взаимным раствором солей поликремниевых кислот: 
В химии солей кремниевых кислот — силикатов — ввиду сложности их состава традиционной является запись формулы силиката как смешанного оксида. В случае стекол это полностью оправдано и тем, что они являются нестехиометрическими смесями солей, и тем, что они аморфны и не имеют регулярной структуры. Основное технологически ценное качество стекла — его пластичность, позволяющая при высоких температурах определенными приемами формировать из него изделия различных назначений и форм. Пластичность стекла — следствие его аморфного строения и некоторой гибкости цепей Si—О—Si.
Содержание оксидов других элементов придает стеклам разнообразные ценные свойства: твердость, жаростойкость, устойчивость к выщелачиванию и действию химических реактивов. Содержание В203, например, придает стеклу тугоплавкость и жаропрочность, наличие ВаО и В203 — химическую стойкость, содержание РЬО и оксидов переходных металлов — высокий показатель преломления и различные окраски. Особенно ценятся оптические свойства — прозрачность, коэффициент преломления, цвет, превращающие стекло в материал для изготовления красивой утвари и посуды.
Кристаллические силикаты и алюмосиликаты. Природные и синтетические кристаллические силикаты, как и поликремниевые кислоты и кварц, имеют в качестве структурной единицы кремнекислородный тетраэдр Si04 (см. рис. 18.8). Кремнекислородные тетраэдры всегда соединяются друг с другом только одной вершиной и никогда ребрами или гранями. В результате этого существует большое многообразие кристаллических силикатных структур — простые и циклические анионы, существующие в ряде минералов. Каждый конкретный способ соединения кремнекислородных тетраэдров Si04 в пространстве называется кремнекислородным мотивом минерала. Различные минералы могут иметь одинаковые мотивы, так как кремнекислородная анионная часть у них одна и та же и различаются они лишь катионами. К числу простейших по мотивам относятся «островные» силикаты (рис. 18.9).
Так, самыми простыми являются ортосиликат магния оливин (Mg, Fe)2Si04 и диортосиликат тортвейтит Sc2|Si207|, в которых существуют анионы Si04 и [Si207]r>. Островными также оказываются силикаты с замкнутыми циклическими aHHOHaMn[Si309]6_ и [Si^O^]12-, образующие минералы бенитоит BaTi[Si309] и берилл Be3Al2[Si6018].
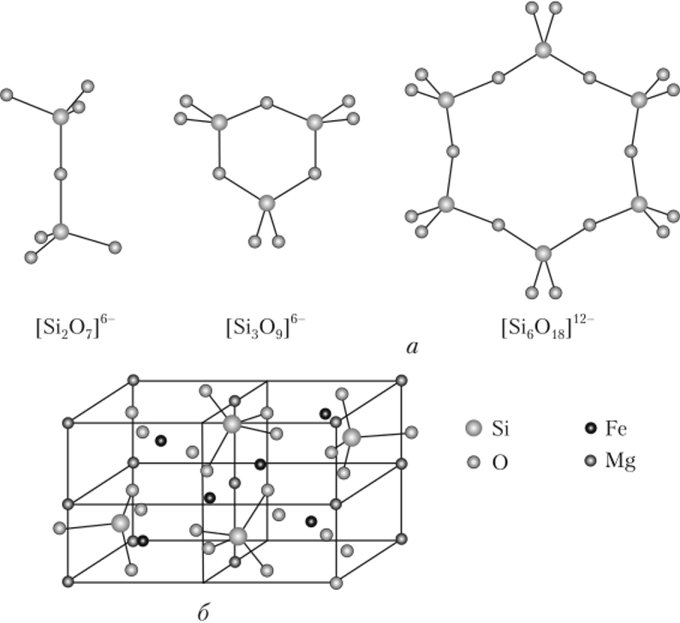
Рис. 18.9. Структура островных силикатов:
а — полимерные анионы; б — кристаллическая решетка оливина Соединяясь в цепные и ленточные полианионы, кремнекислородные тетраэдры образуют два больших класса минералов: пироксепы и амфиболы. Пироксены имеют простейший повторяющийся фрагмент [Si206]4-, амфиболы — [Si40n]6~ (рис. 18.10).
Катионы, положительный заряд которых нейтрализует отрицательный заряд силикатных полиаиионов пироксенов и амфиболов, располагаются между цепями и лентами. Этими катионами обычно являются катионы щелочных (Li+, Na+, К+), щелочноземельных (Mg2+, Са2+) металлов, а также Al3+, Fe2+, Fe3+. К числу пироксенов и амфиболов относится большое число минералов, масса которых в сумме превышает 15% массы земной коры. К числу амфиболов относится асбест, волокнистая структура и легкая расщепляемость которого объясняются относительно слабой связанностью амфиболовых лент друг с другом.
Амфиболовые ленты мысленно легко достроить и превратить их в бесконечные слоистые анионы (рис. 18.11). Мине;
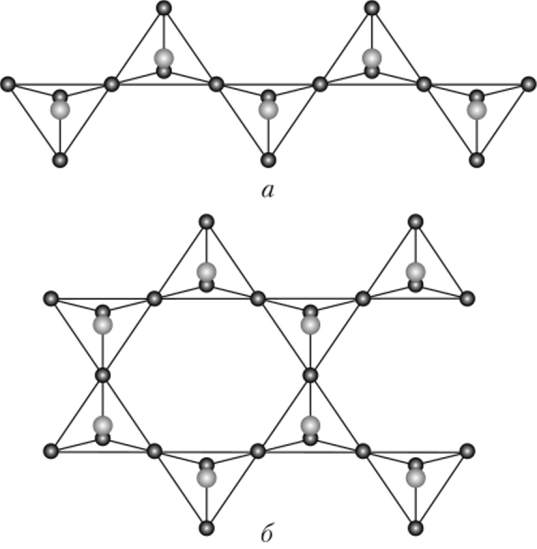
Рис. 18.10. Структура цепных полианионов — пироксенов (а) и ленточных полианионов — амфиболов (б).
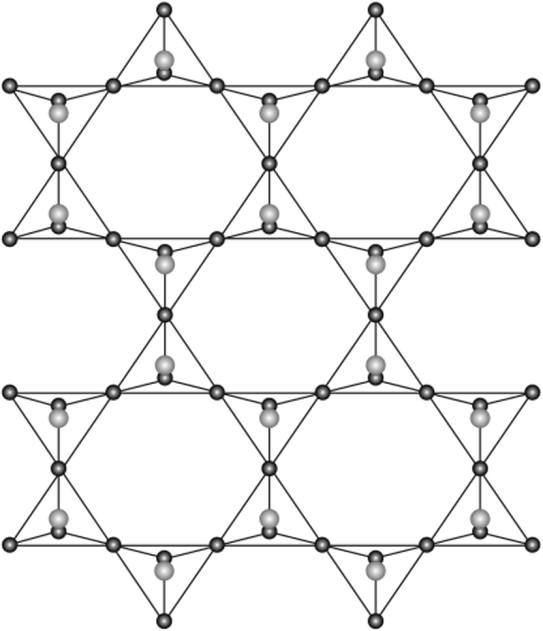
Рис. 18.11. Структура листового полианиона.
ралы с такими слоистыми или листовыми анионами широко распространены в природе. Силикатные слои в них могут иметь не только шестиугольные ячейки, как в амфиболовой ленте. К числу таких слоистых минералов относят слюды, в которых часть кремнекислородных тетраэдров заменена на алюмокислородные АЮ|". Слоистая структура этих алюмосиликатов проявляется в чешуйчатое™, в их способности расщепляться на пластинки. Примером слюд с простым составом может служить мусковит KAl^AlS^O^KOII)^ Мусковит является, как очевидно из его формулы, минералом, в котором алюминий в виде алюмокислородного тетраэдра включен в мотив, и, кроме того, катион А1л+ нейтрализует отрицательный заряд алюмосиликатных слоев. Мусковит можно назвать алюмосиликатом алюминия.
К числу слоистых относится группа минералов, образующих глины. Некоторые из них обладают так называемой пакетной структурой. Например, каолинит Al2|Si205](OH)4 имеет пакет из двух слоев: слоя из кремнекислородных тетраэдров и слоя из октаэдрически окруженных атомами кислорода атомов алюминия. Первый слой имеет отрицательный, а второй — положительный заряд. Минералы типа каолинита не являются алюмосиликатами. Это силикаты алюминия.
Наиболее распространенными в природе являются каркасные силикаты, анионы которых имеют трехмерное строение. Как и двухмерные ячейки в случае слоистых минералов, их трехмерные полости могут быть разных размеров и иметь разные формы. К числу каркасных алюмосиликатов относятся полевые шпаты — важнейшие породои почвообразующие минералы. Их масса составляет около 50% массы земной коры. По катионам, входящим в структуру, различают натриево-кальциевые (плагиоклазы Ca[Al2Si208] и Na[AlSi308]) и щелочные (ортоклаз К[ AlSi308|) полевые шпаты.
Многие каркасные алюмосиликаты с крупными полостями и каналами, называемые цеолитами, способны обменивать свои катионы с внешними водными растворами. Искусственные цеолиты находят широкое применение как средство селективного выделения веществ. Их называют «молекулярными ситами», так как размер их каналов и полостей строго определяет «габариты» молекул, способных проникнуть внутрь их кристаллов.