Железо.
Неорганическая химия

Соединения железа (И). Катион Fe2+ имеет электронную конфигурацию dG. Он образует комплексные соединения со многими моно-, бии полидентатными лигандами (см. табл. 23.8). Эти комплексные соединения чаще всего имеют форму октаэдра. Окрашенные в очень бледный голубоватозеленый цвет аквакатионы2+ присутствуют в водных растворах многих солей Fe2+ и сохраняются в их кристаллогидратах. Входящие… Читать ещё >
Железо. Неорганическая химия (реферат, курсовая, диплом, контрольная)
Железо Fe в химически чистом состоянии представляет собой блестящий серебристо-белый, мягкий и ковкий металл. При обычных температурах существует a-Fe, являющееся ферромагнетиком. К ферромагнетикам наряду с a-Fe относятся также никель, кобальт и некоторые редкоземельные металлы. Главная особенность всех ферромагнетиков — самопроизвольная намагниченность, которая возникает в результате особого взаимодействия неспаренных электронов-подуровней их атомов. В результате такого взаимодействия эти электроны имеют параллельные спины и, следовательно, параллельные магнитные моменты. При температуре 769 °C a-Fe теряет ферромагнитные свойства и превращается в p-Fc, которое отличается от a-формы только магнитными свойствами: оно парамагнитно. При еще более высоких температурах существуют y-Fe и a-Fe, которые отличаются своими кристаллическими структурами и физическими свойствами от a-Fe.
При обычных температурах железо — средний по химической активности металл. В сухом воздухе оно защищено от взаимодействия с кислородом тончайшей оксидной пленкой.
При нагревании до температур выше 200 °C и во влажном воздухе скорость коррозии железа увеличивается. Причем в присутствии влаги наряду с оксидами образуются и гидроксиды, главным образом метагидроксид железа (Ш) FeO (OH), из которого в основном состоит ржавчина.
При нагревании железо реагирует с галогенами, серой, азотом, фосфором, углеродом и кремнием. Часто состав бинарных соединений, образующихся в результате этих реакций, меняется в зависимости от условий их протекания. При взаимодействии с разбавленными кислотами-неокислителями образуются растворы солей Fe2+:

Концентрированные кислоты-окислители (азотная и серная) пассивируют железо в результате образования нерастворимой в них оксидной пленки.
В водных растворах наиболее устойчивая степень окисления железа равна +3. Соединения, содержащие Fe2+, менее устойчивы. Они окисляются растворенным в воде кислородом. В комплексных соединениях для Fe2+ и для Fe3+ характерно координационное число 6 и образование октаэдрических координационных сфер. Поэтому окисление Fe2+ до Fe3+ не сопровождается радикальной перестройкой этих сфер. Происходит только изменение длин связей.
Соединения железа (И). Катион Fe2+ имеет электронную конфигурацию dG. Он образует комплексные соединения со многими моно-, бии полидентатными лигандами (см. табл. 23.8). Эти комплексные соединения чаще всего имеют форму октаэдра. Окрашенные в очень бледный голубоватозеленый цвет аквакатионы [Fe (H20)6]2+ присутствуют в водных растворах многих солей Fe2+ и сохраняются в их кристаллогидратах. Входящие в координационную сферу молекулы воды часто замещаются другими лигандами, например, в растворах и кристаллах гексагидрата хлорида железа (Н) FeCl2 • 61120 содержатся структурные единицы состава | FeCl2(Н20)4 ]. В результате такого замещения часто изменяется устойчивость Fe2+ к окислению. Например, катион гсксаакважелеза (П) окисляется иначе, чем комплексные анионы, в которых лигандами служат цианид-ионы CN- и этилендиаминтетраацетат-ионы ЭДТА: 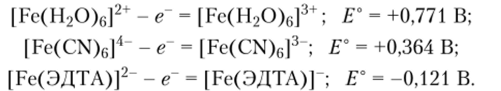
Большинство комплексных соединений Fe2+ в водных растворах лабильно, но известны и инертные комплексные соединения. Очень прочным и инертным является гексацианоферрат (П)-ион [Fe (CN)6]4-.
Fe2+ образует соли практически со всеми анионами. Многие из них хорошо растворимы в воде. Водные растворы солей Fe2+ имеют кислую реакцию из-за гидролиза по катиону. При выпаривании водных растворов соли Fe2+ выделяются в виде кристаллогидратов, например FeCl2-4H20, Fe (N03)2-6H20, FeS04-7H20 (железный купорос). Свежеосажденные кристаллы солей Fe2+, как правило, имеют зеленый цвет, но при храпении на воздухе они окисляются кислородом и теряют кристаллизационную воду, приобретая желто-коричневую окраску. Исключение составляет довольно устойчивая на воздухе двойная соль: сульфат железа (П)-аммония (NH4)2Fe (S04)2-6H20, известная под тривиальным названием соль Мора. Некоторые соли Fe2+ с двухи трехзарядными анионами плохо растворимы. К их числу относятся: карбонат FeCO.3, сульфид FeS и ортофосфат Fe3(P04)2-8H20 железа (П). В природе октагидрат ортофосфата железа (Н) образует минерал вивианит.
При действии сильных оснований на растворы солей железа (П) образуется малорастворимый гидроксид железа (II) бледно-зеленого цвета:

При контакте с кислородом воздуха он быстро окисляется до метагидроксида железа FeO (OH), приобретая характерный для него бурый цвет. Гидроксид железа{) — амфотерное основание. Он растворяется в кислотах и растворах сильных оснований:

Оксид железа (П) FeO — нерастворимое в воде кристаллическое вещество черного цвета. Он легко окисляется и, проявляя амфотерные свойства, растворяется в кислотах и растворах сильных оснований.
Анализируя свойства соединений Fe2+, можно сделать вывод: соединения Fe2+ проявляют восстановительные свойства.
Соединения железа (III). Катион Fe3+ имеет электронную конфигурацию d. Константы устойчивости его комплексных соединений значительно больше, чем у Fe2+, так как он имеет больший заряд. Особой прочностью среди комплексных анионов с монодентатными лигандами выделяется гексацианоферрат (Ш)-ион [Fe (CN)6]3 .
Светло-фиолетовый аквакатион [Fe (H20)6]3+ устойчив только в очень кислых растворах, в которых в соответствии с принципом Ле Шатслье подавляется его диссоциация, приводящая к образованию комплексных катионов, содержащих в координационной сфере гидроксид-ионы и окрашивающих растворы в желтый цвет:

Сильное подкисление растворов предотвращает также и образование осадков, потому что в кислых растворах вправо смещены также равновесия образования многоядерных комплексов, например:
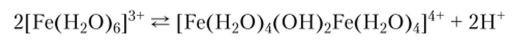
Катион Fe3+ образует соли с большинством анионов, за исключением тех, которые он может окислить. Например, известны все галогениды железа (Ш), за исключением иодида, поскольку стандартный окислительно-восстановительный потенциал Е° = +0,536 В для полуреакции.
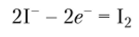
меньше, чем стандартный окислительно-восстановительный потенциал для полуреакции.
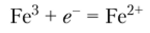
который равен +0,771 В.
Большинство важнейших солей железа (Ш) — хорошо растворимые в воде, гигроскопичные, расплывающиеся на воздухе вещества. Они выделяются из водных растворов в виде кристаллогидратов. К их числу относятся: хлорид FeCl3-6H20 (желто-коричневый), нитраты Fe (N03)2-9H20 (светло-фиолетовый) и Fe (N03)2 • 6Н20 (бесцветный), Fe2(S04)3-9H20 (желтый). В водных растворах соли желе;
за (Ш) сильно гидролизованы. Продукты гидролиза: одноядерные и многоядерные гидроксокомплексы. Эти соли используют в качестве коагулянтов при очистке воды, протравы при крашении. При добавлении к растворам солей Fe3+ дигидрофосфата натрия образуется кристаллогидрат малорастворимого ортофосфата железа (Ш) FeP04? 2Н20. При взаимодействии растворов солей Fe3+ с карбонатили гидрокарбонат-ионами в осадок выпадает гидроксид железа (Ш).
Кристаллогидраты двойных сульфатов железа (Ш) и однозарядного катиона (NH+ или К+) называют железными квасцами, например: додекагидрат сульфата железа (Ш) и аммония NH4Fe (S04)2 • 12Н20 известен иод тривиальным названием железо-аммонийные квасцы. В кристаллах квасцов катионы Fe3 ~ и однозарядные катионы образуют координационные сферы, состоящие из шести молекул воды.
При повышении pH растворов солей железа (Ш) из них выделяется бурый аморфный осадок практически нерастворимого в воде гидроксида железа (Ш) РсуОз-г/ЬЬО, имеющий переменное содержание воды. Упрощенно формулу гидроксида железа) часто записывают как Fe (OFI)3. Гидроксид железа{III) — очень слабое амфотерное основание. Он легко взаимодействует с кислотами с образованием аквакатионов [Fe (H20)g)]3+ и гораздо труднее с растворами сильных оснований с образованием гексагидроксоферратов (Ш):
В природе гидроксид железа (Ш) образует ряд минералов, которые объединяют под названием бурые железняки. В их число входит, например, гётит Fe203 — Н20 или FeO (OH).
При прокаливании Fe203 «H20 превращается в амфотерный оксид железа (Ш) Fe203, который существует в природе в виде минерала гематита.
Соединения железа^III) проявляют окислительные свойства.
При восстановлении Fe203 водородом или мопооксидом углерода образуется черный кристаллический, практически нерастворимый в воде смешанный оксид железа (П, III) Fe304 или Fe0 Fe203. Существующий в природе минерал такого состава называют магнетитом или магнитным железняком.
Железо в природе. По распространенности в земной коре (4,65%) железо занимает четвертое место, уступая лишь кислороду, кремнию и алюминию. В горных породах и почвах его считают макроэлементом. По своей значимости для растений и животных оно занимает промежуточное положение между макрои микроэлементами. Поведение железа в окружающей среде определяется его способностью легко изменять степень окисления и образовывать химические связи с кислородом, серой и углеродом. Увеличение окислительновосстановительного потенциала и pH почв приводят к осаждению железа. Наоборот, в кислых почвах и в присутствии восстановителей соединения железа растворяются. В почвах железо присутствует главным образом в виде оксидов (гематит, магнетит) и гидроксидов (гётит). В затопляемых содержащих серу почвах в восстановительных условиях образуется пирит FeS2. С органическим веществом почвы железо образует хелаты. Доля растворимых неорганических соединений железа: аквакомплексов, [Fe (H20)50H]2+, [Fe (H20)4(0H)2]+ составляет незначительную часть общего содержания железа в почвах. Важную роль в миграции железа и обеспечении им корневой системы растений играет образование комплексных соединений с органическими веществами почвы. Большую роль в окислении и восстановлении железа в почвах играют микроорганизмы. Их деятельность сказывается на растворимости, а следовательно, и на доступности соединений железа для растений. Многие виды бактерий участвуют в образовании некоторых минералов железа. Увеличению подвижности железа способствуют антропогенные факторы: кислотные дожди, внесение подкисляющих почву удобрений и избыток органических удобрений. В кислых почвах с низким содержанием кислорода возрастает концентрация соединений Fe2+, которые могут быть токсичными для растений.
В засушливых районах на нейтральных и слабощелочных карбонатных почвах растения могут испытывать дефицит железа. В этих условиях возникает необходимость применения железных удобрений. Их используют также при выращивании растений на искусственных субстратах в условиях защищенного грунта. Чаще всего используют хелатное соединение диэтилентриаминпентаацетат железа (Fe-ДТПА). В тепличных хозяйствах применяют цитрат железа (П) Рез (С6Н507)2*ЗН20. Для некорневых подкормок используют сульфат железа (П) и хлорид железа (Ш).
Корни растений обычно поглощают железо в виде катионов Fe2+. Предварительно на их поверхности происходит восстановление Fe3+ до Fe2+. Перенос железа в растениях осуществляется в виде хелатных комплексных соединений, в которых лигандами служат цитрат-ионы. В растительных тканях железо связано с цитрат-ионами и ферредоксином. Дигидрофосфат-ионы связывают Fe3+ в FeP04-2H20 и могут мешать поглощению железа растениями и его перемещению в них.
Определенные концентрации железа в растениях необходимы как для нормального развития растений, так и для правильного питания человека и животных. Железо играет чрезвычайно активную роль в жизнедеятельности любых организмов. Оно образует ферменты, катализирующие окислительно-восстановительные процессы, комплексы, служащие для переноса электронов, металлопротеины, являющиеся переносчиками кислорода. Так, важнейший фермент, с помощью которого азотфиксирующие организмы связывают молекулярный азот, содержит активный центр, в котором атомы железа и молибдена связаны с атомом серы. Координация молекулы N2 и ее превращение в аммиак в этом ферменте осуществляются по схеме, приведенной в упрощенном виде на рис. 23.5.
Столь же велика роль железа в процессах фотосинтеза и дыхания растений. В ферредоксинах, белках хлоропластов, содержащих кубические кластеры типа Fe4S4 (см. рис 20.7), железо, благодаря легкости превращения Fe2+ в Fe3+, служит электрическим мостом, по которому электрон переходит от возбужденного светом хлорофилла к окислителям.
В организмах высокоразвитых животных железо в степени окисления +3 переносится с потоком крови железосодержащими белками — трансферринами. Они не связывают Fe2+. Трапсферрины доставляют Fe3+ к местам биосинтеза других железосодержащих соединений: цитохромов и гемоглобина. Цитохромы — сложные белки, осуществляющие перенос электронов от окисляемых органических веществ к кислороду.
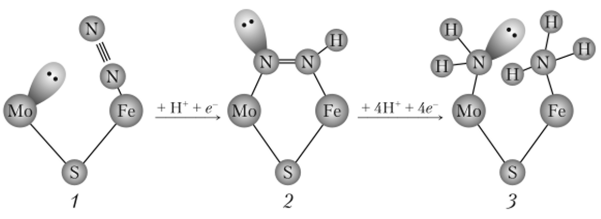
Рис. 23.5. Схема биологической фиксации азота:
1 — образование линейного комплекса Fe—N=N; 2 — образование двухъядерного комплекса Mo—N=NII—Fe; 3 — разрыв связи N=N и образование аммиака Эти ферменты предназначены для синтеза аденозинтрифосфата (АТФ) и содержат гем, т. е. комплекс, имеющийся и в гемоглобине:
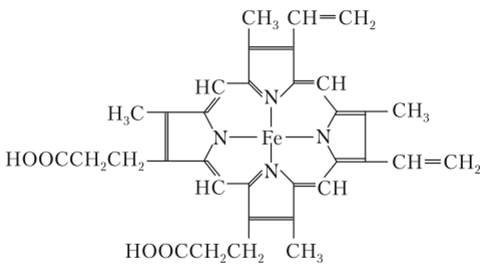
Железо в порфириновом кольце гема легко переходит из степени окисления +2 в +3 и обратно, благодаря чему и происходит перенос электрона. Гемоглобин (см. рис. 19.10), как и ряд других железосодержащих белков, служит для переноса молекулярного кислорода.