Кислоты серы.
Химия

Сера образует многочисленные кислоты, разнообразие которых обусловлено тем, что в них, во-первых, могут существовать цепочки из атомов серы и, во-вторых, в них могут содержаться атомы серы в различных степенях окисления. Большинство кислот неустойчиво, хотя соответствующие им соли в ряде случаев хорошо известны. Необходимо учесть, что потенциалы всех переходов более отрицательны, чем потенциал… Читать ещё >
Кислоты серы. Химия (реферат, курсовая, диплом, контрольная)
Сера образует многочисленные кислоты, разнообразие которых обусловлено тем, что в них, во-первых, могут существовать цепочки из атомов серы и, во-вторых, в них могут содержаться атомы серы в различных степенях окисления. Большинство кислот неустойчиво, хотя соответствующие им соли в ряде случаев хорошо известны.
Раствор S02 в воде обычно называют сернистой кислотой — H2S03, хотя на самом деле кислотные свойства этого раствора определяются диссоциацией гидрата:
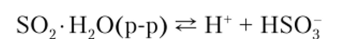
Соответствующая константа диссоциации невелика:
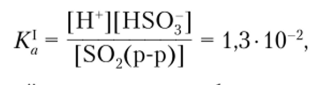
и поэтому соли сернистой кислоты — сульфиты— в растворе сильно гидролизованы.
Особое место в ряду кислот серы занимает серная кислота. Это один из важнейших продуктов химической промышленности. Мировое произволство серной кислоты составляет около 160 млн т. Серную кислоту получают, но реакции.
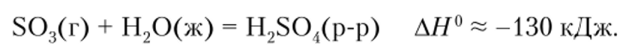
В системе S03 — Н20 существует несколько соединений определенного состава (рис. 21.2). Растворы, в которых молярное отношение S03/H90 > 1 (или иначе растворы SQ3 в H2S04), называются олеумом.

Рис. 21.2. Диаграмма плавкости системы S03 — Н20.
Максимумы на кривой отвечают температурам плавления указанных соединений.
Серная кислота — сильная двухосновная кислота (Юа = 103; К" = 1,2 • 10~2). При растворении концентрированной кислоты в воде в растворе сразу образуется большое количество ионов водорода, которые гидратируются с большим выделением теплоты. Поэтому, если смешать 1 моль H2S04 с необходимым для полной гидратации протонов количеством воды (более 100 моль Н20), выделяющейся теплоты (81,5 кДж) достаточно, чтобы нагреть раствор на 20 °C. Если же количество воды мало, а кислоты — велико, то в месте контакта температура повышается настолько, что происходит испарение части воды и может произойти разбрызгивание кислоты.
Именно поэтому при разбавлении концентрированной серной кислоты нужно приливать небольшими порциями кислоту к воде, но ни в коем случае не наоборот.
Концентрированная серная кислота используется как осушитель газов, и она настолько энергично реагирует с водой, что разрушает многие органические вещества, отнимая от них элементы воды (2Н + О) и оставляя свободный углерод.
В разбавленных растворах ион SO2- не проявляет заметных окислительных свойств, поэтому серную кислоту обычно используют в тех случаях, когда в растворе надо создать кислую среду, индифферентную по отношению к окислению или восстановлению.
Концентрированная серная кислота — довольно сильный окислитель.
Холодная кислота окисляет HI и H2S:

При нагревании концентрированная серная кислота реагирует с серой, углеродом и такими неактивными металлами, как медь, ртуть, серебро. Например: 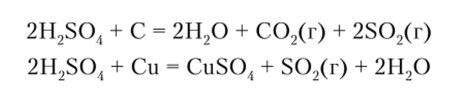
В большинстве случаев восстановление H2S04 идет до S02, но активные металлы — цинк, магний и др. частично восстанавливают ее до H2S:
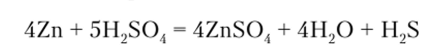
Ив других кислородсодержащих соединений серы следует упомянуть пероксодисерную и тиосерную кислоты и их соли.
Пероксодисерная кислота HS03—О—О—S03H содержит пероксидную группировку, заключенную между двумя крупными фрагментами HS03 и поэтому труднодоступную для взаимодействия. В результате ион в кислой среде выступает в роли сильного (Е° = 2,01 В), но кинетически инертного окислителя. Хорошим катализатором для реакций с его участием является ион серебра, в присутствии которого персульфат-ион легко окисляет Мп2+ до Мп04:
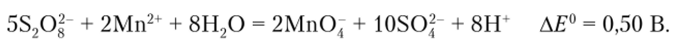
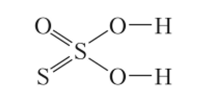
В тиосерной кислоте H2S203 один атом серы замещает атом кислорода в H2S04:
Сама кислота неустойчива и быстро разлагается:
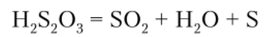
но ион S203 кинетически устойчив, и соединение Na2S203 под названием тиосульфат натрия или гипосульфит широко используется в фотографии и медицине.
В растворах ион S903" проявляет восстановительные свойства. Сильные окислители переводят его в ион SO2, а слабые — в тетратионатный ион (S03—S—S—S03)2, включающий цепочку из четырех атомов серы:
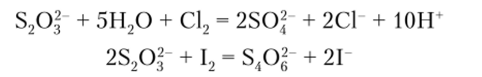
Возможность существования соединений серы в водных растворах определяется соотношением восстановительных потенциалов. Для стандартного кислого раствора схема восстановительных потенциалов наиболее важных форм представлена ниже.

С позиций термодинамики в стандартном кислом растворе растворенный S02 должен дисиропорционировать на серу и серную кислоту:

Сера не должна диспропорционировать в кислой среде, но это означает, что H2S не должен сосуществовать с растворенным S02 или серной кислотой:
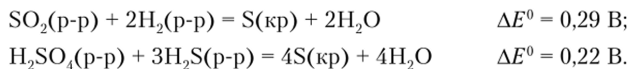
Потенциалы всех переходов менее положительны, чем потенциал окисления воды (1,23 В), и вода не окисляется соединениями серы, но это означает, что все они (за исключением иона SO2-) должны окислятся кислородом воздуха. Например: 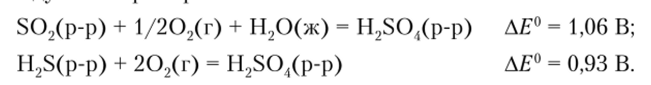
Таким образом, в стандартном кислом растворе, находящемся в контакте с воздухом, термодинамически устойчив только ион SO2-.
При переходе к стандартной щелочной среде (pH = 14) восстановительные потенциалы становятся менее положительными, а в ряде случаев переходят в отрицательную область (Е°, pH = 14):
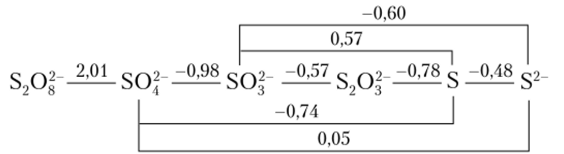
Поведение серы в щелочном растворе аналогично поведению хлора — она должна диспропорционировать на ион S2 и ион SO2 или SO2 :
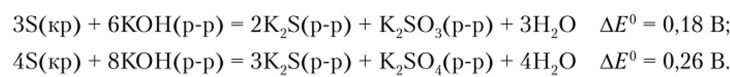
Ион SO2, подобно иону СЮ3, неустойчив по отношению к диспропорционированию, и, кроме того, он должен восстанавливать воду (в щелочном растворе ?0(Н2О/Н2 = -0,83 В):
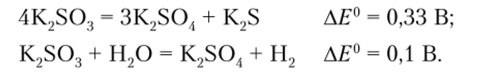
Необходимо учесть, что потенциалы всех переходов более отрицательны, чем потенциал восстановления кислорода (?0(О2/ОН) = 0,40 В), а значит, он должен окислять все соединения серы до иона S02~. Таким образом, с позиций термодинамики в щелочном растворе, как и в кислом, устойчив только ион SO^ .
Кинетика ограничивает реальное протекание большинства рассмотренных реакций. Так, все реакции с участием свободной серы как реагента при стандартных условиях заторможены, и только при кипячении сера растворяется в растворе щелочи.
Реакции с участием кислорода имеют высокие энергии активации и при стандартных условиях идут медленно, но все же с заметной скоростью, и поэтому в растворах сульфиты, так же как и сернистая кислота, в присутствии воздуха медленно окисляются до ионов S04".
Подобно хлоратам, сульфиты по отношению к диспропорционированию кинетически устойчивы даже в кипящих растворах, но при прокаливании до ~ 600 °C этот процесс идет:

Ион SO3 — как в кислых, так и в щелочных растворах является хорошим восстановителем, а ион S04_ проявляет лишь очень слабые окислительные свойства.