Аммиак.
Химия

Молекула аммиака пирамидальна, причем угол Н—N—Н, равный 107,3°, близок к тетраэдрическому углу (109,5°). С позиций метода МО это говорит о значительном вкладе 5-электроиов в систему связей, а с позиций метода ВС — о локализации неподеленной пары электронов на зр3-гибридной орбитали (см. рис. 3.9). Таким образом, по своему электронному строению молекула аммиака подобна молекуле воды, что… Читать ещё >
Аммиак. Химия (реферат, курсовая, диплом, контрольная)
Вообще азот плохо реагирует с газообразными и легколетучими реагентами. Причины этого не только кинетические, но и термодинамические. Вопервых, энергия связи в молекуле N2 так велика, что связи азота с другими элементами уступают ей и поэтому реакции свободного азота в большинстве своем эндотермические или слабо экзотермические. Во-вторых, азот — газ и его связывание в процессе реакции обычно сопровождается уменьшением числа молей газа, а значит, и уменьшением энтропии. Следовательно, с увеличением температуры изменение энергии Гиббса становится все менее выгодным. Таким образом, при низких температурах реакции с участием N9 не идут из-за больших энергий активации этих молекул, а при высоких температурах они невыгодны термодинамически.
С этих позиций исключительно интересной является реакция азота и водорода с образованием аммиака:
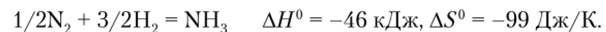
При реакции число молей газа уменьшается, АН0 и AS0 имеют одинаковые знаки, и константа равновесия, равная единице при 200 °C, с повышением температуры уменьшается.
Поэтому с позиций термодинамики синтез следует вести при низких температурах и высоких давлениях, тогда равновесие будет максимально сдвинуто вправо — в сторону образования аммиака. Однако, из-за большой прочности связи в молекулах, особенно связи N=N, энергия активации реакции настолько велика, что ее скорость становится заметной только при таких температурах, когда равновесие синтеза практических нацело сдвинуто влево. Это означает, что синтез возможен только в присутствии катализатора. В промышленности используются катализаторы на основе железа с различными добавками — А1203, К20 и др. С экономически оправданными скоростью и выходом синтез ведется при температурах 400—600оС и давлениях 10—100 МПа.
В лабораторных условиях небольшие количества газообразного аммиака получают, действуя щелочью на соли аммония:
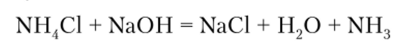
или приливая концентрированный раствор аммиака к твердой щелочи.
Молекула аммиака пирамидальна, причем угол Н—N—Н, равный 107,3°, близок к тетраэдрическому углу (109,5°). С позиций метода МО это говорит о значительном вкладе 5-электроиов в систему связей, а с позиций метода ВС — о локализации неподеленной пары электронов на зр3-гибридной орбитали (см. рис. 3.9). Таким образом, по своему электронному строению молекула аммиака подобна молекуле воды, что определяет сходство в свойствах этих веществ. Как и в воде, в жидком аммиаке существуют водородные связи, поэтому его температура кипения (-33°С) относительно велика (у фосфина -87°С).
Подобно воле, жидкий аммиак самоионизипуется:
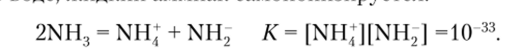
Он является хорошим растворителем для многих неорганических и органических веществ и применяется для проведения различных синтезов. Для аммиака характерно три типа взаимодействий:
1) реакции комилексообразования с участием неподеленной электронной пары;
- 2) реакции замещения водорода;
- 3) реакции окисления азота.
Так, например, аммиак образует многочисленные комплексы с ионами переходных металлов, имеющими вакантные d-орбитали:
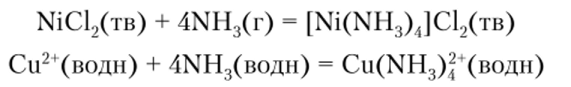
Хорошо реагирует аммиак с галогенидами p-элементов. Например:
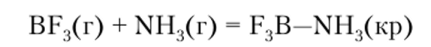
Чрезвычайно охотно он взаимодействует с протоном, образуя ион аммония:
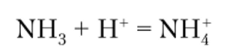
Эта реакция исключительно характерна для аммиака и протекает с участием многих протонсодержащих веществ, например кислот:
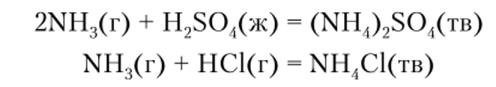
По своим размерам и заряду ион аммония близок к ионам щелочных металлов, и соли аммония во многом похожи на соли этих элементов, в частности практически все они хорошо растворимы в воде. Характерным свойством солей аммония является их низкая термическая стойкость — уже при небольшом нагревании они разлагаются на аммиак и соответствующую кислоту:

Если кислота проявляет окислительные свойства, то при нагревании таких солей ион аммония, как правило, окисляется:
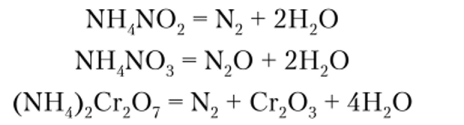
Аммиак очень хорошо растворим в воде. При комнатной температуре один объем воды растворяет около 700 объемов NH3. В водном растворе молекулы аммиака частично участвуют в общей системе водородных связей, а кроме того, образуют замкнутые молекулы гидрата NH3 — Н20:
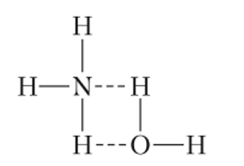
Следует подчеркнуть, что гидрат NH3-H20 не аналогичен гидроксиду аммония, в котором должна была бы существовать связь H4N—ОН. Поскольку азот не может образовать пять ковалентных связей, таких молекул не существует.
Аммиак прочнее удерживает протон, чем вода 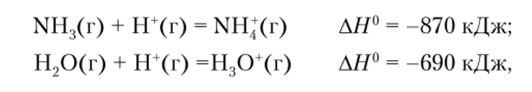 поэтому равновесие
поэтому равновесие 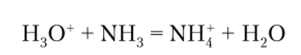
смещено вправо и при растворении аммиака в воде концентрация ионов Н^СГ по сравнению с чистой водой уменьшается, а значит, концентрация ионов ОН увеличивается. В результате раствор аммиака в воде имеет щелочные свойства. Количественно они характеризуются константой, которая рассчитывается по отношению ко всему растворенному аммиаку:
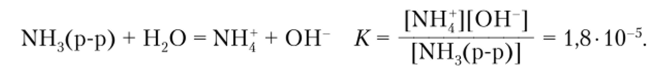
Отсюда следует, что в растворе аммиака с концентрацией 1 моль/л равновесная концентрация гидроксид-ионов близка к 4−10_3 моль/л, а pH такого раствора около 11.
Помимо реакций комплексообразования, аммиак вступает в многочисленные реакции замещения. При повышенных температурах аммиак взаимодействует со щелочными металлами с образованием амидов MNH2 и имидов M2NH: 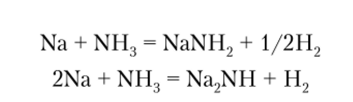
Существует громадное количество производных типа NH2R, NHR2 и NR3, где R — органический радикал. Например, N (CH3)3 — триметиламин (см. параграф 34.1).
Еще одна группа реакций, в которые вступает аммиак, — это реакции его окисления. При этом аммиак используется либо как восстановитель, например: 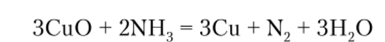
либо как объект окисления с целью получения других соединений азота.
Реакция окисления аммиака кислородом чрезвычайно важна как промежуточная стадия получения азотной кислоты. Энергия активации этой сложной реакции велика, и при комнатной температуре процесс полностью заторможен. По мере повышения температуры развивается два параллельных конкурирующих процесса:

Как очевидно из сопоставления величин ДС°, оба процесса сильно экзотермичны и AG,0 более отрицательно, чем ДG2°, т. е. окисление аммиака до свободного азота термодинамически выгоднее, чем до NO.
Исследования показали, что платина может быть эффективным катализатором обоих процессов окисления и, что очень важно, NO является промежуточным продуктом при окислении NH3 до N9. Поэтому, если время контакта с катализатором достаточно мало, процесс окисления доходит только до образования NO, который, как мы увидим, может быть далее окислен до азотной кислоты.