Химия углерода.
Химия

Графит — это такая форма углерода, в которой его атомы находятся в состоянии .^-гибридизации, sp2-Гибридные орбитали направлены к вершинам треугольника, поэтому в графите каждый атом углерода связан с тремя соседями, образуя плоскую сетку, и, кроме того, имеет один несиаренный электрон на негибридизованной р-орбитали, перпендикулярной к плоскости сетки (рис. 24.1). Что энергия, выделяющаяся при… Читать ещё >
Химия углерода. Химия (реферат, курсовая, диплом, контрольная)
Изучив материал, изложенный в главе 24, обучающийся должен: знать
- • положение элемента «углерод» в периодической системе;
- • строение электронной оболочки атома углерода;
- • методы получения и свойства метана, оксидов, кислот, галогенидов и карбидов углерода, циана и синильной кислоты;
уметь
- • написать формулы соединений углерода с водородом, кислородом, галогенами;
- • составлять обменные и окислительно-восстановительные реакции с участием соединений углерода;
- • определить характер связей, образуемых углеродом в соединениях с водородом, кислородом, галогенами, металлами;
владеть
- • навыками определения свойств элемента и простых веществ;
- • представлениями об устойчивости соединений углерода в водных растворах;
- • о роли углерода и его оксидов в химических производствах.
Элемент и простые вещества
Для начала отметим особое состояние электронной оболочки атомов элементов 14-й группы вообще и атома углерода в частности. Мы уже неоднократно говорили о том, что в атомах 5- и /7-элементов валентными являются четыре орбитали — одна 5-АО и три р-АО. У всех элементов 14-й группы на этих орбиталях находится по четыре электрона, и в этом смысле 4-я группа является некоторым «водоразделом» среди s- и /7-элементов: слева от нее располагаются электронно-дефицитные элементы, справа — электронно-избыточные. Тем не менее, начиная с кремния, эти элементы могут легко повышать свое координационное число с четырех до шести за счет использования близко лежащих вакантных d-АО, с участием которых образуются 5р3б/2-гибридные орбитали. Таким образом, фактическое число валентных АО у атомов элементов 14-й группы больше числа валентных электронов. Из всех элементов группы только углерод не имеет вакантных d-АО, и, если не считать атома водорода, атом углерода — единственный атом, в котором число валентных электронов действительно равно числу валентных орбиталей.
Атом углерода в основном состоянии имеет конфигурацию 2s22p2 с двумя неспаренными p-электронами, 5-парой и вакантной /7-орбиталью. В таком состоянии атом углерода может образовать две обычные ковалентные связи, причем 25-пара и вакантная /7-орбиталь остаются неиспользованными. Энергетически такая ситуация исключительно невыгодна. Установлено,
что энергия, выделяющаяся при образовании даже одной связи, образуемой атомом углерода, достаточна для перевода атома с затратой 400 кДж/моль в новое валентное состояние с гибридизованными орбиталями sp, sp2 или sp В любом случае при гибридизации используются заполненная sи вакантная р-АО, а число неснаренных электронов становится равным четырем.
В природе углерод сосредоточен в карбонатных породах — известняках (СаСОэ), образующих громадные залежи, и некоторых других карбонатах (MgC03). Встречается углерод в свободном состоянии — каменный уголь, графит, алмаз, а также в виде органических веществ — флора, фауна, нефть, природные газы.
Количество соединений углерода столь велико, что для их описания потребовалось выделить самостоятельное направление в химии — органическую химию. Число известных органических соединений углерода приближается к 3,5 млн, тогда как число соединений всех остальных элементов составляет около 120 тыс.
В большинстве соединений углерод образует четыре ковалентные связи, но они не могут быть реализованы в двухатомной молекуле С2, поэтому простые вещества представляют собой полимерные кристаллические структуры. Углерод образует четыре простых вещества — алмаз, графит, карбины и фуллерены.
В алмазе каждый атом углерода находится в состоянии-гибридизации и образует четыре равноценные a-связи с другими атомами (см. рис. б. б). Кристалл алмаза прозрачен в видимой области, имеет высокий коэффициент преломления и самую большую твердость из всех природных веществ. Основные месторождения алмазов сосредоточены в Южной Африке, Индии, Якутии. Самым крупным алмазом до сих нор остается найденный в 1905 г. в Южной Африке кристалл размером 10×6,5×5 см и массой 621,2 г (3106 карат, 1 карат = 0,2 г).
Графит — это такая форма углерода, в которой его атомы находятся в состоянии .^-гибридизации, sp2-Гибридные орбитали направлены к вершинам треугольника, поэтому в графите каждый атом углерода связан с тремя соседями, образуя плоскую сетку, и, кроме того, имеет один несиаренный электрон на негибридизованной р-орбитали, перпендикулярной к плоскости сетки (рис. 24.1).
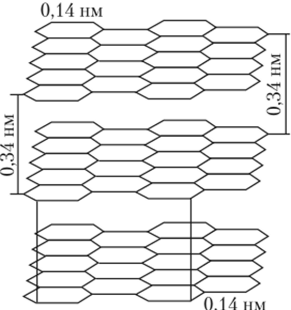
Рис. 24.1. Слоистая структура графита.
Расстояние между слоями в полтора раза больше, чем между атомами в слоях Эти электроны образуют общую систему я-связей, которая представляет собой наполовину заполненную зону проводимости. В результате графит имеет слоистую структуру, причем связь между слоями осуществляется в основном за счет относительно слабых межмолекулярных сил. Все это определяет свойства графита — он мягок, легко расслаивается, имеет серый цвет и металлический блеск, заметно электропроводен и химически более активен, чем алмаз.
Третья форма существования углерода — карбин — черный мелкокристаллический порошок. Его структурные фрагменты — линейные молекулы, в которых атомы находятся в состоянии хр-гибридизации. Два оставшиеся электрона нар-орбитали образуют я-связи. При этом возможно два варианта распределения связей в цепи:
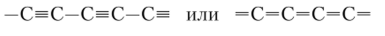
Реально существуют обе линейные структуры. Карбины более активны, чем графит.
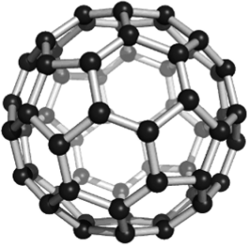
Рис. 24.2. Молекула фуллерена С60.
В фуллеренах атомы углерода связаны многоцентровыми связями, при этом образуются правильные многогранники, в вершинах которых располагаются атомы. Наиболее характерны системы, содержащие 60 или 70 атомов, представляющие собой практически сферические частицы (рис. 24.2).
Сажа, древесный уголь и другие угли, получаемые из органического и неорганического сырья, представляют собой мелкокристаллический графит, так что обычно термином «углерод» обозначают именно графит той или иной степени дисперсности.
При стандартных условиях углерод (графит) весьма инертен. Uh не реагирует с кислородом, водородом, галогенами. На него не действуют растворы кислот и щелочей. При нагревании углерод сгорает в кислороде или на воздухе с образованием СО.,. С другими неметаллами, кроме фтора и серы, углерод непосредственно не реагирует. Взаимодействие с металлами возможно только при высоких температурах (1000—2000°С), а с водородом — еще и при высоких давлениях (~10 МПа). Низкая реакционная способность углерода (графита) позволяет использовать его как материал для тиглей, электродов, как замедлитель нейтронов в ядерных реакторах.