Основы конформационного анализа

Рассмотрим, например, молекулу этана. При вращении одной метильной группы в этане относительно другой на 360° молекула трижды принимает каждую из приведенных форм (А и Б). В форме Б атомы водорода находятся на минимальном расстоянии друг от друга и максимально взаимодействуют. Подобную форму молекулы называют.шслоненной. Энергетически наиболее выгодным оказывается положение, при котором одна… Читать ещё >
Основы конформационного анализа (реферат, курсовая, диплом, контрольная)
Поворот вокруг двойной связи невозможен без нарушения л-связи, что требует затраты энергии около 250 кДж/моль. Это является причиной существования цис трансизомерии олефинов и их производных.
Вращение вокруг простой связи долгое время считалось свободным. Лишь в 1936 г. была впервые высказана мысль, что это вращение заметно затруднено. При сближении двух несвязанных атомов на расстояние, чуть меньшее суммы ван-дер-ваальсовых радиусов, начинается противодействие — отталкивание электронных оболочек этих атомов, которое резко увеличивается по мере их дальнейшего сближения. При образовании связи расстояние между двумя атомами углерода становится меньше суммы их ван-дер-ваальсовых радиусов. Соответственно сближаются в пространстве и связанные с этими атомами группы настолько, что становится возможным пространственное взаимодействие между ними.
Рассмотрим, например, молекулу этана. При вращении одной метильной группы в этане относительно другой на 360° молекула трижды принимает каждую из приведенных форм (А и Б). В форме Б атомы водорода находятся на минимальном расстоянии друг от друга и максимально взаимодействуют. Подобную форму молекулы называют .шслоненной. Энергетически наиболее выгодным оказывается положение, при котором одна метильная группа повернута относительно другой на 60°. Разница в энергиях этих двух положений составляет около 12 кДж/моль. Благодаря этой разности в энергиях вращение группы СН3 вокруг связи С—С в этане становится неравномерным. Попав в наиболее выгодное положение, молекула в нем задерживается, как бы тормозится. Поэтому такую формулу молекулы называют заторможенной (Л):

Для того чтобы построить проекцию Ньюмена, молекулу рассматривают вдоль связи между двумя атомами; эти атомы изображают кружком, а связи их с другими атомами — линиями, направленными от точки за пределами круга к его центру. Линии, представляющие связи атомов, находящихся ближе и дальше от наблюдаемых атомов, заканчиваются соответственно в центре круга или на окружности. Если же связи при проекции накладываются друг на друга, то их изображают, немного сдвинув относительно друг друга.
При небольшом запасе энергии (при низких температурах) молекула не может выйти из заторможенного положения. Таким образом, полное свободное вращение метильных групп невозможно. Метильные группы лишь несколько отклоняются от заторможенного положения в ту или в другую сторону. Если же запас энергии молекулы превышает 12 кДж/моль, молекула последовательно переходит из одного заторможенного состояния в другое, быстро проскакивая промежуточное положение противостояния, и вращение делается полным.
Этан при обычной температуре (0—20 °С) представляет собой смесь молекул с сильным (1000/1) преобладанием формы А. Чем выше температура, тем больше вероятность перехода и тем легче он происходит, и наоборот.
Таким образом, потенциальная энергия молекулы этана зависит от двугранного угла <�р между двумя связями С—Н у соседних атомов углерода, принятых за основные. При ф, равном 120 и 240°, реализуется заслоненная конформация (А), а при ф, равном 60. 180 и 300°, — заторможен;

Рис. 61. Потенциальная энергия молекулы этана как функция угла ф между метильными группами.
ная конформация (Б). На рис. 61 изображено изменение потенциальной энергии молекулы этана в зависимости от изменения угла ф.
В случае молекулы бутана возможны две заторможенные конформации. Они называются гош и анти конформациями. Их удобно представить с помощью проекционных формул Ньюмена. Гош и анти конформации — наиболее стабильные конформации молекулы бутана, причем анти конформация немного более стабильна, чем гош, потому что в первой две метильные группы расположены так далеко друг от друга, как только возможно. Имеющееся различие в энергии между конформациями приводит к тому, что в любой момент времени 69*%" молекул бутана находится в анти-конформации, а 31% — в гош конформации:

В других молекулах с более объемными заместителями разница между энергиями соответствующих состояний больше, чем у этана. Например, у гексахлорэтана она составляет около 62 кДж/моль, поэтому свободное вращение в молекулах гексахлорэтана при комнатной температуре заметно заторможено.
Энергетически неравноценные формы молекул, переходящие друг в друга только за счет свободного вращения или изгиба связей, называются конформациями.
Для каждой молекулы возможно громадное число разных конформаций, но большинство из них энергетически невыгодно, и любое реальное вещество представляет собой смесь молекул, большая часть которых находится в наиболее выгодных состояниях. Любая конкретная конформация молекулы является лишь временным ее состоянием — молекулы постоянно переходят из одной конформации в другую. С удлинением углеродной цепи молекулы число возможных конформаций растет и их энергетические взаимоотношения осложняются.
Рассмотрение возможных конформаций соединения, выбор наиболее выгодной, сравнение конформаций переходных состояний, объяснение направления реакции с точки зрения конформационных представлений или предсказание этого направления, изучение физических и химических свойств конформеров объединяются понятием конформационный анализ.
В алициклическом ряду эти представления наиболее разработаны для шестичленных циклов. В алициклических углеводородах кроме углового напряжения, которое тем выше, чем больше отклонение валентного угла в цикле от тетраэдрического, существует напряжение, связанное с тем, что атомы водорода находятся частично или полностью в заслоненных положениях. В циклопропане, например, каждый атом углерода связан с двумя другими и невалентных взаимодействий атомов углерода друг с другом нет. Иначе обстоит дело в случае циклобутана, где помимо углового напряжения и энергии взаимодействия четырех пар атомов водорода существует некоторое дополнительное напряжение, связанное с взаимодействием между первым и третьим атомами углерода, расстояние между которыми равно всего 0,22 нм.
Теоретический расчет суммы всех напряжений в плоском циклобутане приводит к цифре, которая намного превосходит экспериментальную величину, полученную из термохимических данных. Поэтому в настоящее время принято считать, что в циклобутане один из атомов цикла несколько выдается над плоскостью трех остальных. Выход атома углерода из плоскости цикла уменьшает общую энергию напряжения в циклобутане.
Напряжение в цикле, возникающее вследствие того, что для некоторых этановых фрагментов цикла невозможны наиболее выгодные заторможенные конформации, называется торсионным (поворачивающим). Неплоская конформация циклопентана возникает именно из-за торсионного напряжения.
В циклопентане почти нет углового напряжения (отклонение валентного угла от тетраэдрического составляет всего 0°44'), однако торсионное напряжение значительно. Оно связано с взаимным отталкиванием пяти пар атомов водорода, находящихся в заслоненных положениях. В результате этого один из атомов углерода выходит из плоскости цикла на * 0,05 нм, хотя такое искривление цикла несколько увеличивает угловое напряжение. Неплоскостное расположение атомов в циклопснтане доказано методом дифракции электронов:

При построении модели циклогексана отчетливо видно, что угловое напряжение заметно уменьшается для конформации типа «кресло* и типа «ванна*:

Однако конформация «кресло* полностью свободна от торсионного напряжения (все этиленовые фрагменты имеют заторможенную конформацию).

в то время как в конформации «ванна* этиленовые фрагменты имеют заслоненную конформацию, что довольно невыгодно с энергетической точки зрения. Разница в свободных энергиях обоих конформеров (около 33 кДж/моль) слишком мала для того, чтобы конформеры можно было разделить как индивидуальные вещества, но достаточно велика, чтобы циклогексан существовал преимущественно в конформации «кресло*.
Молекула циклогексана, находящаяся в конформации «кресло*, при обычных условиях (20 °С) претерпевает быструю инверсию (около 105 раз в секунду):

При этом все экваториальные атомы водорода становятся ак спальными, и наоборот (см. далее).
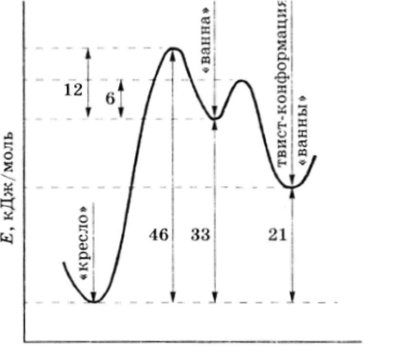
Рис. 62. Энергетика конформационимх переходов в незамещенном циклогексане.
Если конформацию «ванны» подвергнуть скручиванию, то можно заметно уменьшить торсионное напряжение, и твист-форма уже только на 21 кДж/моль менее выгодна, чем форма «кресло»:

Энергетика конформационных переходов изображена на рис. 62.

Рассмотрим теперь направление связей С—Н в конформации «кресло» циклогексана. Проведем плоскость, наиболее близкую ко всем углеродным атомам циклогексана в форме «кресло»:
Шесть атомов водорода располагаются приблизительно в этой плоскости по экватору молекулы — они называются экваториальными (Нс), шесть же С—Н-связей направлены приблизительно перпендикулярно этой плоскости — они называются аксиальными (На). Каждый из шести атомов углерода циклогексана имеет одну аксиальную и одну экваториальную связь. Объемные заместители в молекуле циклогексана стремятся занять экваториальные положения (меньше пространственные затруднения) и часто определяют конформацию цикла.
Очень важную роль в развитии конформационного анализа сыграл метод ПМР. В связи с тем что химический сдвиг и константы спин-спинового взаимодействия различны для Не и Ня, появилась возможность различать конформеры. Обычным приемом является съемка спектров при низких температурах. Так, если при 20 °C обе формы «кресла» переходят друг в друга 105 раз в секунду, то при -80 °С скорость перехода уменьшается на четыре порядка и их уже можно различить в спектре ПМР.
- [1] Подробно с методом конформационного анализа можно ознакомиться в кн.: Потапов В. М. Стереохимия. — М.: Химия, 1976.