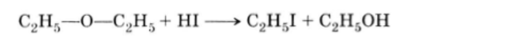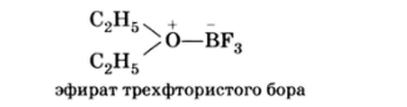Реакционная способность эфиров невелика. Они не изменяются при нагревании с водой, щелочами и разбавленными кислотами. В отличие от спиртов при взаимодействии с металлическим натрием в обычных условиях они не выделяют водород. Только концентрированная иодоводородная кислота разлагает эфиры:
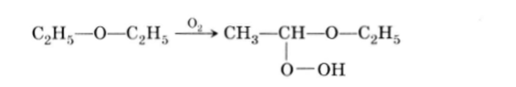
При хранении, особенно на свету, простые эфиры медленно окисляются кислородом воздуха, образуя крайне взрывчатые гидроперекиси, что может послужить причиной серьезного несчастного случая при перегонке эфиров:
Эфиры перед перегонкой всегда необходимо проверять на присутствие пероксидов реакцией с KI в присутствии крахмала, идущей с выделением иода. Если реакция положительна, пероксиды перед дальнейшей работой должны быть удалены.
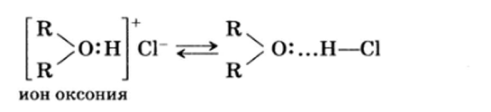
Своеобразно отношение простых эфиров к концентрированным протонным кислотам: эфиры растворяются в них с выделением теплоты. При этом образуются непрочные соединения солеобразного характера — оксониевые соединения (по аналогии с аммониевыми соединениями).
Образование оксониевых соединений можно представить следующим образом. У эфирного атома кислорода имеется пара неноделенных электронов: протон кислоты образует связь с этой парой, в результате чего получается непрочный положительно заряженный ион оксония:
Оксониевая соль находится в равновесии с системой, состоящей из молекул эфира и кислоты, связанных водородной связью. Этим можно объяснить малую электрическую проводимость оксониевых солей.
По такому же типу построено и соединение эфира с трехфтористым бором (кислотой Льюиса):
В соединениях этого типа имеется типичная донорно-акцепторная связь (см. гл. 1).
Методы идентификации простых эфиров
В связи с прочностью связи С—О—С в простых зефирах их химическая идентификация затруднена. Применяют реакцию в жестких условиях с HI с образованием алкилиодидов.
В ИК-спектре простые зефиры обычно имеют интенсивную полосу поглощения в области 1150—1070 см *, вызванную асимметричными валентными колебаниями группировки С—О—С.
В УФ-области поглощение простых эфиров лежит в труднодоступной коротковолновой части спектра и поэтому не применяется для идентификации.
Кислород в простых эфирах в спектрах ПМР оказывает такое же влияние на соседнюю алкильную группу, как и гидроксильная группа. На рис. 68 приведен спектр ПМР диизопропилового эфира. На нем отчетливо видны дублет от четырех эквивалентных групп CH;i (J =6,1 Гц, ин;
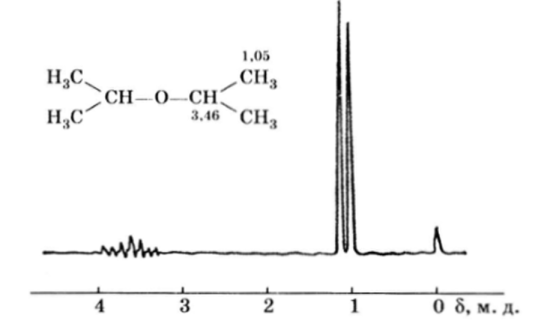
Рис. 68. ПМР-спектр д и изопропилового эфира (J 6,1 Гц)
теней в ноет ь 12 протонов) и септет двух эквивалентных групп СИ, обусловленный расщеплением на соседних 6 протонах (J * 6,1 Гц, интенсивность 2 протона).