Порядковый номер элемента теперь принято называть его атомным номером и обозначать буквой Z. Атомный номер лежит в основе систематизации химических элементов и определяет их положение в периодической системе.
При определенном атомном номере, т. е. при определенном числе протонов, в ядре могут находиться разные числа нейтронов, поэтому могут существовать отличающиеся по массе разновидности атомов одного и того же элемента — изотопы.
Например, природный водород представляет собой смесь изотопов с массовыми числами 1 и 2 (они обозначаются JH и 2Н), а природный уран — это смесь 29®U (99,276%), (0,718%) и 2^U (0,0056%). В современной литературе также распространен термин «нуклид» — совокупность атомов с определенным зарядом ядра и массовым числом (суммой чисел протонов и нейтронов в ядре). Нуклиды обозначают названием элемента, к которому через дефис присоединяют значение массового числа (например, бор-11 или уран-238), или символом элемента, рядом с которым слева вверху указано массовое число (nB, 238U).
В периодической таблице элементы расположены в порядке увеличения заряда ядра, а в отдельных клеточках таблицы принято приводить средневзвешенные (с учетом распространенности в природе различных изотопов) атомные массы, поэтому они часто сильно отличаются от целочисленных (рис. 2.2).

Рис. 2.2. Элемент периодической таблицы.
Определение точных значений масс атомов и разделение изотопов стало возможным в результате создания масс-спектрометрии — метода, основанного на воздействии магнитного поля на направление пучка заряженных частиц (рис. 2.3, а).
Газ вводится в эвакуированный прибор через трубку (1) и подвергается ионизации потоком электронов из электронной пушки (2). Заряженные пластины (3) и (4) разгоняют поток полученных положительных ионов, который проходит через щель в пластине (4) и попадает в поле магнита (5), отклоняющее отдельные ионы в соответствии с отношением масса/заряд. За второй щелью (6) расположен детектор (7), который регистрирует число частиц, прошедших через щель. Меняя напряженность магнитного поля, можно последовательно регистрировать относительное количество ионов с различной массой, получая масс-спектр.
На рис. 2.3, б приведен пример масс-спектра для системы титан — кислород. При температуре около 1700 °C кристаллический ТЮ2 подвергается следующему превращению: ТЮ2(кр.) —? ТЮ2(газ) + ТЮ (газ) + 02(газ).
В масс-спектрометре молекулы газа переходят в ионы. Показана область масс-спектра, соответствующая ионам ТЮ+ и ТЮ2+. Отдельные полосы отвечают пяти изотопам титана с массой 46 (7,9%), 47 (7,3%), 48 (73,9%), 49 (5,5%), 50 (5,4%).
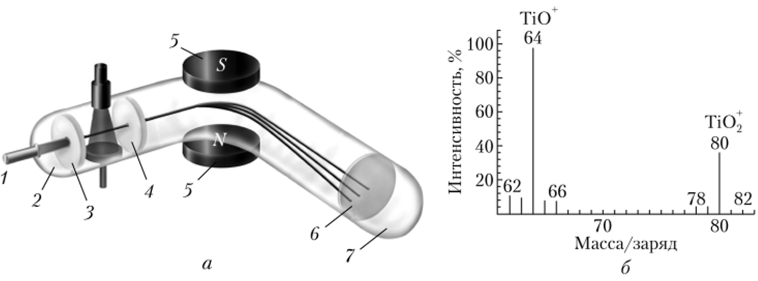
Рис. 2.3. Масс-снектрометрия:
а — масс-спектрометр; б — масс-спектр системы титан — кислород.


