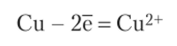Примеры решения задач

Решение: Степень окисления серы (в H2S) = -2; иода (в HI) = = -1. Так как и сера и иод находятся в своих низших степенях окисления, то оба вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут. Магний имеет меньший стандартный потенциал (-2,37 В), поэтому является анодом (анод всегда более активный элемент и всегда растворяется). На аноде протекает… Читать ещё >
Примеры решения задач (реферат, курсовая, диплом, контрольная)
1. Исходя из степени окисления (п) азота, серы и марганца в соединениях NH3, HN02, HN03, H2S, H2S03, H2S04, Mn02 и KMn04, определите, какие из этих веществ могут быть только восстановителями, только окислителями, а какие проявляют как окислительные, так и восстановительные свойства.
Решение. Степень окисления в указанных соединениях соответственно равна:
- — для азота N 3Н3: -3 (низшая), HN+302: +3 (промежуточная), HN+503: +5 (высшая);
- — для серы II2S-2: -2 (низшая), II2S+403: +4 (промежуточная), H2S+604: +6 (высшая);
- — для марганца Мп+402: +4 (промежуточная), КМп+704: +7 (высшая).
Отсюда следует: NH3, H2S — только восстановители;
— HN03, H2S04, KMn04 — только окислители;
IIN02, II2S03, Mn02 — обладают окислительно-восстановительной двойственностью.
2. Могут ли происходить окислительно-восстановительные реакции между H2S и HI?
Решение: Степень окисления серы (в H2S) = -2; иода (в HI) = = -1. Так как и сера и иод находятся в своих низших степенях окисления, то оба вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут.
3. Составьте схему гальванического элемента, в котором электродами являются магний и цинк, опущенные в растворы их солей с концентрацией ионов 1 моль/л. Определите катод и анод, напишите уравнения электродных процессов и суммарной окислительно-восстановительной реакции и вычислите ЭДС гальванического элемента.
Решение. Схема данного гальванического элемента запишется в виде.
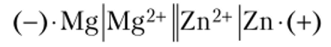
Магний имеет меньший стандартный потенциал (-2,37 В), поэтому является анодом (анод всегда более активный элемент и всегда растворяется). На аноде протекает процесс окисления:
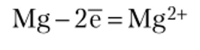
Стандартный электродный потенциал цинка (-0,763 В) больше, чем потенциал магния, поэтому цинк — катод. На этом электроде протекает процесс восстановления:
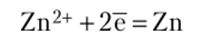
Суммарное уравнение окислительно-восстановительной реакции имеет вид.
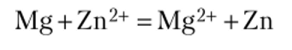
ЭДС (Е) гальванического элемента равна (фкаТода «Фанода):
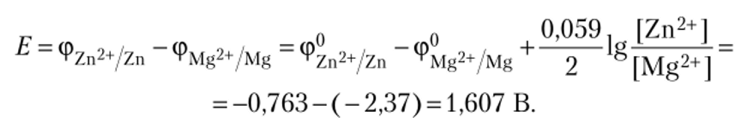
4. Как протекает коррозия цинка, находящегося в контакте с медыо, в нейтральной среде? Составьте уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Решение. В месте контакта меди и покрытия цинка с влагой возникает микрогальвантческий элемент, схему которого можно записать в видс2п |Н2 0|Си. Согласно данным табл. П. 7,ф 2"2+/Zn = -0,76 В, Фси2+/си = +0'34 В‘Таким обРазом' Фси2+/Си > Ф°п2+/гп* ПоэтомУ Динк будет анодом, а медь — катодом. Цинк окисляется и переходит в раствор:
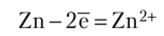
На меди восстанавливается деполяризатор, в данном случае — вода:
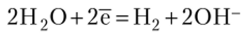
Продуктами коррозии являются водород и гидроксид цинка.
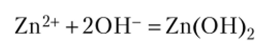
5. Напишите электронное уравнение анодного процесса, происходящего при электролизе водного раствора ZnS04
(Ф? =-0,76 В) на медном аноде.
Zn* /Zn.
Решение. В водном растворе присутствуют ионы диссоциированной соли и Н20:
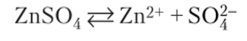
На медном аноде конкурируют процессы окисления меди Си, воды Н20 и ионов SO‘j~. Поскольку стандартный электродный потенциал окисления меди Ф^и2+/Си =+0,34 В существенно ниже потенциалов окисления ионов SO|~ и воды (ф^и2+/Си = +0,34 В и Фо2/н2о = +1,23 В), на аноде окисляется медь (медный анод растворяется):