Анализ смеси анионов первой — третьей аналитических групп (без ионов-восстановителей S2-, SO2-, S20|, и N02)

Осадок (т. е. свободное серебро и избыток цинка) центрифугируют, центрифугат переносят в другую пробирку, а осадок отбрасывают. К 2—3 каплям полученного центрифутата приливают 3—4 капли 2 н. серной кислоты и обнаруживают ионы I- и В гдействием хлорной воды (добавляют по каплям) в присутствии бензола. При одновременном присутствии ионов И и Вгхлорная вода сначала окисляет иодид-ион до свободного… Читать ещё >
Анализ смеси анионов первой — третьей аналитических групп (без ионов-восстановителей S2-, SO2-, S20|, и N02) (реферат, курсовая, диплом, контрольная)
Обычно анионы обнаруживают дробным методом в отдельных порциях раствора. Строгая последовательность операций при этом необязательна. К реакциям отделения прибегают лишь в немногих случаях, например при совместном присутствии анионов Cl~, Br~, Iили S2~, SO§_, S20§_ и SO^-. Анализ начинают с предварительных испытаний, позволяющих установить отсутствие некоторых ионов. Затем приступают к обнаружению отдельных ионов, которые могут присутствовать в растворе.
Предварительные испытания
- 1. Определение реакции раствора. Кислая реакция анализируемого раствора указывает на отсутствие в нем анионов летучих и неустойчивых кислот, например СО§_. Реакцию среды проверяют с помощью синей лакмусовой бумаги: покраснение бумаги при нанесении на нее капли раствора указывает на кислую среду; в нейтральной и щелочной средах окраска не изменяется.
- 2. Проба на анионы первой группы и обнаружение иона SO^". Если раствор кислый, его нейтрализуют раствором Ва (ОН)2. К 2—3 каплям нейтрального или слабощелочного раствора добавляют 3—4 капли группового реагента ВаС12. Выпадение осадка указывает на присутствие анионов первой группы. Если появился осадок, то необходимо проверить в нем присутствие сульфат-иона: жидкость удаляют пипеткой, а к осадку добавляют А—5 капель 2 н. раствора НС1, перемешивают осадок в пробирке. Нерастворимость его в 2 н. хлороводородной кислоте — признак присутствия иона SO^-.
- 3. Проба на анионы второй группы и их обнаружение. К 2—3 каплям исследуемого раствора добавляют 3—4 капли раствора AgN03 и 2—3 капли 2 н. раствора HN03. Нерастворимость полученного осадка в 2 н. азотной кислоте подтверждает присутствие анионов второй аналитической группы.
Если анионы второй группы присутствуют, то необходимо добиться полного осаждения их раствором нитрата серебра, отцентрифугировать. Центрифугат отделяют, а осадок промывают и используют его для обнаружения ионов СЬ, Вг~ и I-.
3.1. Растворение хлорида серебра и обнаружение иона С1~. Прибавляют к осадку 20—30 капель 12%-ного раствора карбоната аммония (NH4)2C03 и взбалтывают в течение 1 мин. При этом хлорид серебра растворяется с образованием [Ag (NH3)2]Cl, бромид и иодид серебра остаются в осадке. Отцентрифугировав осадок, центрифугат переносят в другую пробирку и проверяют присутствие С1~. Прибавляют несколько капель 2 н. раствора азотной кислоты, комплекс [Ag (NH3)2]Cl разрушается с образованием осадка хлорида серебра. Появление мути AgCl указывает на присутствие хлорид-иона в анализируемом растворе.
Оставшийся осадок промывают, добавив к нему 4—5 капель дистиллированной воды, центрифугируют, центрифугат отделяют, а осадок исследуют на присутствие бромиди иодид-ионов.
3.2. Обнаружение Вг и 1~. К осадку добавляют 5—6 капель дистиллированной воды, немного цинковой пыли. Тщательно перемешивают содержимое пробирки палочкой около 1 мин. Цинк восстанавливает серебро, образуя растворимые соли: ZnBr2, Znl2.
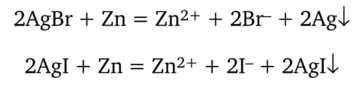
Осадок (т. е. свободное серебро и избыток цинка) центрифугируют, центрифугат переносят в другую пробирку, а осадок отбрасывают. К 2—3 каплям полученного центрифутата приливают 3—4 капли 2 н. серной кислоты и обнаруживают ионы I- и В гдействием хлорной воды (добавляют по каплям) в присутствии бензола. При одновременном присутствии ионов И и Вгхлорная вода сначала окисляет иодид-ион до свободного иода — слой бензола окрасится в красно-фиолетовый цвет. Дальнейшее приливание хлорной воды приводит к обесцвечиванию фиолетовой окраски, так как иод окисляется до иодат-ионов Ю§. После этого начинается окисление бромид-ионов до свободного брома, окрашивающего слой бензола в желто-бурый цвет.
Обнаружение отдельных анионов
- 4. Обнаружение иона СО|_. 5—6 капель испытуемого раствора помещают в склянку прибора для обнаружения газов (см. параграф 12.2, реакции СО§~) и приливают 6—8 капель 2 н. НС1. Выделение пузырьков газа и помутнение известковой воды указывает на присутствие иона СО§_.
- 5. Обнаружение иона РО^_. К 2 каплям анализируемого раствора прибавляют А—5 капель молибденовой жидкости, нагревают на водяной бане, добавляют несколько кристаллов нитрата аммония и дают постоять. В присутствии иона РО|_ выпадает желтый осадок (NH4)3[PMO12O40].
6. Обнаружение иона SiOj-. К 3—4 каплям исследуемого раствора прибавляют 2 капли 2 н. раствора NH4OH, 3 капли насыщенного раствора хлорида аммония и в течение 2—3 мин нагревают на водяной бане.
В присутствии аниона SiO§~ выпадает белый студенистый осадок кремниевых кислот.
- 7. Обнаружение иона NO3. На чистое и сухое предметное стекло наносят 1—2 капли раствора дифениламина в концентрированной серной кислоте, вносят в него стеклянной палочкой немного испытуемого раствора и перемешивают. В присутствии NO3 появится интенсивносиняя окраска.
- 8. Обнаружение иона ВО2. Помещают в тигель 5—6 капель анализируемого раствора, выпаривают досуха, дают остыть. К сухому остатку приливают 2—3 капли концентрированной серной кислоты и немного этанола, поджигают смесь. В присутствии иона ВО2 пламя окрашивается в зеленый цвет.
Контрольные вопросы и задания
- 1. Какие реагенты необходимы для идентификации аммофоса, сульфата и хлорида аммония? Составьте соответствующие уравнения реакции, укажите условия их выполнения.
- 2. Перечислите основные аналитические реакции на обнаружение нитратов, бромидов и иодидов в природных водах. Составьте соответствующие уравнения реакции, укажите условия их выполнения.
- 3. Как можно определить присутствие карбонат-ионов в почвенной вытяжке? Составьте соответствующие уравнения реакции и укажите условия выполнения.
- 4. Какие реагенты необходимы для идентификации борных микроудобрений? Каковы условия и техника выполнения реакций на обнаружение боратиона?
- 5—10. Исходя из значений предельно допустимой концентрации (ПДК) анионов в питьевой воде и чувствительности аналитических реакций, предложите необходимые реагенты для обнаружения следующих ионов:
№ п/п. | ||||||
Анион. | NO2. | Вг- | I; | NO3. | ро^; | ВО2. |
ПДК, мг/л. | 0,25. | 0,1. | 0,1. | 3,5. | 0,5. |
Составьте схему анализа воды на обнаружение указанных анионов, условия выполнения.